au sommaire
Nous avons du fer dans le sang mais à quoi sert-il ? Découvrez les principales molécules avec du fer en biologie : les hèmeshèmes et les métalloprotéines.

Certains suppléments alimentaires sont à base de fer. © Maxx-Studio, Shutterstock
Hèmes, hémoprotéines et hémoglobines
Les hèmes sont des complexes fer-porphyrine dans lesquels les deux hydrogènes centraux sont remplacés par du fer. La plus importante de ces molécule est le protohème IX, soit de son nom chimique le 1,3,5,8-tétraméthyl-2,4-divinyl-6,7-acide propionique-porphine.
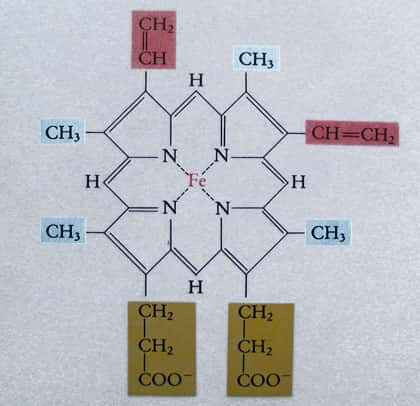
Formule de l'hémoglobine.
Cette molécule va donner les hémoprotéines en s'associant à diverses protéinesprotéines. Dans les hémoglobineshémoglobines, le fer central est sous forme ferreuse et sert de site de fixation à l'oxygèneoxygène.
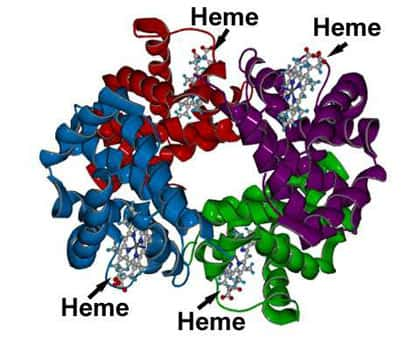
Structure de l'hémoglobine.
Dans les peroxydases et les catalasescatalases, le fer est sous forme ferrique et fixe le peroxyde d'hydrogèneperoxyde d'hydrogène, l'accepteur d'électronsélectrons utilisé par ces enzymesenzymes. Dans les cytochromescytochromes le fer passe de II à III et inversement, ce qui assure le transfert d'électrons.
À titre de comparaison les chlorophylleschlorophylles contiennent du magnésiummagnésium à la place du fer, mais la molécule est très semblable et fonctionne de la même façon !
Les métalloprotéines des protéines non hémiques contenant du soufresoufre. Elles comportent un ou deux atomesatomes de fer et deux de soufre Fe2S2 ou quatre et quatre Fe4S4. Dans ce dernier cas des résidus cystéinecystéine appartiennent à la protéine.
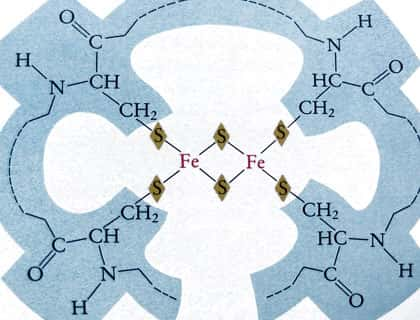
Schéma métalloprotéine du Fe2s2
Dans ces molécules, le fer oscille aussi entre II et III. Certaines de ces métalloprotéines comme les ferredoxines acceptent des électrons à un niveau d'énergieénergie particulièrement élevé (potentiel redox bas). Elles participent à la photo-réduction du NADP et à la formation d'hydrogène moléculaire. A noter que la chaîne respiratoirechaîne respiratoire comporte aussi des protéines fer-soufre. D'autres métauxmétaux interviennent aussi dans de nombreuses oxydasesoxydases comme le cuivrecuivre ou le manganèsemanganèse.
Le fer chez les animaux
Chez les métazoairesmétazoaires à circulation lacunairecirculation lacunaire, l'hémolymphehémolymphe est responsable des transferts d'oxygène dès que la taille de l'animal l'exige : en effet, l'oxygène ne peut diffuser spontanément à plus de 2 mm dans les tissus, il faut donc un transporteur. Seuls quelques groupes très peu exigeants en oxygène peuvent se satisfaire d'une diffusiondiffusion passive comme par exemple les coelentérés, quelques vers inférieurs, les lamellibrancheslamellibranches et quelques poissonspoissons osseux.
L'action du pigmentpigment, déjà saturé à une pressionpression partielle d'oxygène inférieure à celle de l'environnement naturel, est de libérer cet oxygène dans les régions de l'organisme où la pression partielle est basse. Différents pigments respiratoires existent : l'hémoglobine, la myoglobinemyoglobine (réservoir d'oxygène des muscles), la chlorocruorine et l'haemerythrine contiennent du fer et l'hémocyanine du cuivre.
L'affinité pour l'oxygène (mesurée en p50, ce qui correspond à une saturation de 50 % du pigment transporteur) varie beaucoup d'un pigment à l'autre mais l'hémoglobine est la plus performante avec une teneur de 0,3 à 0,4 %. Il y en a plusieurs molécules de PM différents mais c'est elle qui « équipe » les animaux les plus évolués en particulier les homéothermeshoméothermes dont les besoins en oxygène sont très importants.
L'hémoglobine chez l'Homme
Un an après la naissance, le profil hémoglobinique adulte est atteint : il s'agit d'un constituant majeur (> 95 %)).
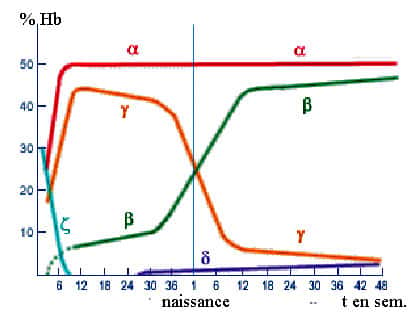
Hémoglobine en fonction de l'âge.
Distribution du fer dans le corps humain
Dans l'organisme, le fer est à l'état ferreux ou ferrique, libre ou inclus dans des complexes hétéroprotéiniques.
| --- | Homme de 70 KgKg | Femme de 60 Kg | |
| Fer actif - hémoglobine (70 % du fer) - myoglobine (6 % du fer) - enzymes et cytochromes | 3 g 0.3 g 0.3 g | 2.5 g 0.2 g 0.3 g | |
| Transport plasmatique : transferrine | 4 mg | 4 mg | |
| Stockage : ferritine + hémosidérine | 0.8 - 1g | 0.4 - 0.5 g | |
| Total du fer | 50-60 mg/Kg | 40-50 mg/Kg |
Métabolisme du fer chez l'Homme
Le corps humain contient 4-5 grammes de fer, normalement : une diminution du fer sérique signe une anémieanémie et une augmentation, une hémochromatosehémochromatose.
Le corps humain consomme du fer, une hémorragie menstruelle normale représente une perte de 20 à 30 mg, la grossessegrossesse, l'accouchementaccouchement et l'allaitementallaitement environ 1 g ; le fer est excrété par la bilebile, les fècesfèces, l'urine, la sueur et les desquamations, ce qui représente 1-2 mg de fer par jour qu'il faut donc compenser par l'alimentation.
De petites quantités de fer II sont résorbées par l'intestin grêleintestin grêle et constitue une sorte de réserve (sous forme de ferritine) que l'on trouve dans la raterate, le foiefoie et la moelle osseusemoelle osseuse où il sera utilisé pour la fabrication de nouveaux globules rougesglobules rouges...
À noter la rapiditérapidité du turnoverturnover du fer puisque la totalité du fer sérique est renouvelée toutes les 3 heures chez l'homme.
Voici les quantités de fer à absorber chaque jour pour compenser les pertes normales. Ces données sont en mg.
| Nourrissons de 3 à 12 mois | 7 à 10 |
| Enfants de 1 à 12 ans | 10 |
| Adolescents en période de croissance | 15 |
| Hommes adultes | 10 |
| Femmes de la pubertépuberté à la ménopauseménopause | 16 à 18 |
| Femmes enceintes | 20 à 30 |
Voici une liste d'aliments riches en fer (teneur en mg pour 100 g d'aliment) :
| Moules | 24 |
| Boudins | 20 |
| Foie | 10-15 |
| FèveFève | 9,0 |
| Pois chichePois chiche | 7,2 |
| LentillesLentilles, jaune d'oeuf | 6,0 |
| Huîtres | 5,5 |
| Noix de cajouNoix de cajou |
5,0 |
Voir aussi sur Futura Quels aliments sont les plus riches en fer ?
Tous les grands groupes de recherche travaillent sur le fer, les carencescarences dans le monde sont très importantes. À titre d'exemple, voici le programme d'une des unités de recherches du CNRS français, le Groupement de recherche du CNRS « Dérégulations du métabolismemétabolisme du fer » ; les grands axes de recherches interdépendants peuvent se décliner de la manière suivante :
- Conception et mise en œuvre d'outils chimiques pour l'étude du métabolisme du fer (nouveaux chélateurs, sondes fluorescentes ou radioactives, etc..). Ces outils constituent des "réactifsréactifs" permettant de "suivre" le fer à l'intérieur de la cellule ;
- Régulation du fer chez les bactériesbactéries, les plantes et les mammifèresmammifères. Ces études fondamentales doivent permettre de mieux comprendre le rôle du fer dans certaines pathologiespathologies ;
- Fer et stressstress oxydant (le stress oxydant est lié à diverses pathologies : vieillissement, inflammationsinflammations, etc..) ;
- Pathologies humaines (hémochromatoses, cancer du foiecancer du foie, syndromesyndrome héréditaire cataractecataracte, hypertransferritinémie, maladies neurodégénérativesmaladies neurodégénératives). Thérapeutiques ;
- Pathologies végétales.
Voir la page de ce dossier consacrée à l'anémie.
Maladies héréditaires et malformation des globules rouges
Nous retiendrons deux maladies héréditairesmaladies héréditaires induisant une malformationmalformation des globules rouges. Elles figurent dans tous les cours de génétiquegénétique : elles concernent des millions d'hommes et de femmes et constituent un des grands problèmes de santé mondiale :
- La thalassémiethalassémie est une anomalie caractérisée par la persistance de l'hémoglobine fœtale faute de synthèse correcte pour l'hémoglobine A. C'est une maladie génétiquemaladie génétique dominante si bien que les hétérozygotehétérozygote Tt sont malades et les homozygoteshomozygotes TT très sévèrement atteints. La thalassémie mineure (Tt) est compatible avec la vie et le risque principal est la transmission de la maladie. La thalassémie majeure ou maladie de Cooley s'observe dès la naissance avec un retard staturo-pondéral, une grosse rate et des anomalies crâniennes. Elle est mortelle vers la dixième année au plus tard. Cette maladie est très répandue dans le bassin méditerranéen surtout à l'est de celui-ci.
- La drépanocytosedrépanocytose, ou anémie falciforme, ou encore sicklémie, est très largement répandue en Afrique tropicale. Vu la forme anormale des hématies le sang a une teneur très faible en oxygène. Les hématies ne peuvent jouer normalement leur rôle de transporteur d'oxygène et il se forme des caillotscaillots dans les capillaires produisant un arrêt de circulation dans les tissus suivi de nécrose. Les hématies anormales sont très vite détruites par l'organisme et ceci entraîne une anémie chronique grave.
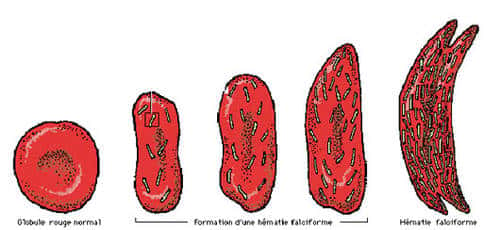
Formation des hématies falciformes.
La drépanocytose est une maladie héréditaire et cependant récessive. Les individus HbsHbs meurent très jeunes. En revanche, les hétérozygotes survivent et devraient être désavantagés par rapport aux homozygotes HbAHbA, mais les médecins chercheurs se sont rendu compte de la proportion anormalement élevée d'hétérozygote et ont fini par découvrir que les hétérozygotes HbsHbA sont plus résistants que les homozygotes dominants HbAHbA au paludismepaludisme.
En effet, le PlasmodiumPlasmodium n'infecte que les globules normaux pas les globules falciformes. Il semble ainsi que cette hétérozygotie semble être un compromis entre une « oxygénation moyenne » et une « infection paludique moyenne » ! On a de plus constaté une corrélation évidente entre les zones de distribution des deux maladies.
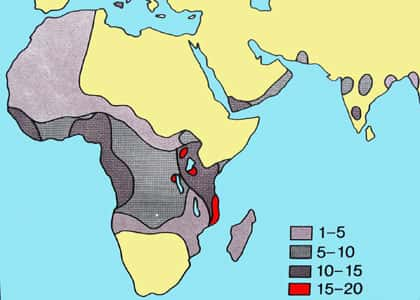
Carte de répartition de la drépanocytose.
Fer : maladies professionnelles et maladies du sport (la pseudo-anémie)
D'autres maladies que les carences peuvent être en relation avec le fer, comme certaines maladies professionnelles ; en particulier, l'inhalationinhalation de poussières de fer peut léser les voies pulmonaires ou conduire à des infiltrations hépatiques, les sidéroses, pulmonaire et hépatique respectivement.
Par ailleurs, chez le marathonien, il est souvent observé une « pseudo-anémie », qui a deux origines :
- Chez le sportif en endurance, de bon niveau, il existe une hémodilution, c'est-à-dire une augmentation du volumevolume plasmatique, ce qui peut faire croire à une anémie.
- Chez le coureur ou le nageur de longue distance, il existe une hémolysehémolyse chronique intra-vasculaire, c'est-à-dire que les globules rouges, pour une infime partie, sont détruits au niveau de la plante des pieds, par choc direct entre la plante du pied et le sol (pour le nageur par choc direct entre la paume des mains et l'eau).
Cette pseudo-anémie n'a pas de répercussion sur la performance sportive, et se corrigera d'elle même, si le sportif sait se ménager des temps de récupération suffisants.

Vase grec avec représentation d'un marathonien.
Cependant, il existe une véritable anémie du marathonien. Si une carence martiale (en fer) se surajoute à ces situations, l'anémie pourra devenir réelle et retentir sur la performance sportive, soit :
- par insuffisance d'apport (régimes hypocaloriques ou déséquilibrés) ;
- par diminution de l'absorptionabsorption intestinale ;
- par accélération du transittransit chez certains sportifs ;
- par augmentation des pertes :
- sudorales : exercices, ambiances chaudes ;
- urinaires : 20 % des marathoniens ont, après la course, une hématuriehématurie microscopique, de cause discutée.
Il faut donc une surveillance régulière des groupes à risque par un dosagedosage de la ferritine, et prendre des mesures adéquates tant au niveau alimentaire que des temps de récupération, bien souvent trop courts.
Hémoglobine et recherche en génie génétique
De l'hémoglobine humaine produite à partir de tabac transgéniquetransgénique : des biologistes français ont déposé une demande de brevet.
« Une équipe de biologistes français annonce, dans le dernier numéro de l'hebdomadaire britannique Nature (daté du 6 mars), avoir réussi à faire synthétiser de l'hémoglobine humaine par des plants de tabac génétiquement modifiés. Ce travail a été réalisé par une équipe dirigée par Michael C. Marden (unité 299 de l'Inserm) et par Bertrand Mérot (groupe Limagrain). C'est une nouvelle et importante première dans le domaine de la manipulation des patrimoines génétiques végétaux à des fins thérapeutiques. Cette substance pourrait en effet être alors utilisée dans de nombreuses situations pathologiquespathologiques caractérisées par des pertes sanguines importantes. Elle ne nécessiterait pas le respect des règles complexes de la compatibilitécompatibilité sanguine et permettrait de prévenir la quasi-totalité des risques infectieux, viraux notamment, inhérents à l'utilisation thérapeutique du sang humain. Dans ce domaine, la mise au point d'un "sang artificiel" a fréquemment été annoncée comme imminente sans que les résultats concrets suivent véritablement. Le résultat des chercheurs français constitue néanmoins une étape importante, et ce, même s'ils se refusent à fixer des délais trop rapprochés quant aux premiers essais cliniquesessais cliniques qui pourraient être effectués chez l'homme avec cette molécule issue du tabac. Il faut, selon eux, compter un délai de quelques années. Dans les plants de tabac rendus transgéniques (mais qui continuent d'avoir une apparence totalement normale), les chercheurs annoncent avoir pu détecter de l'hémoglobine dans les graines et les racines de plus de la moitié des plants. Cette hémoglobine humaine et reproduite dans toute sa complexité est fonctionnelle, capable à ce titre de fixer et de libérer l'oxygène. Le travail publié par les deux équipes française et américaine a fait l'objet d'une demande de brevet déposé en copropriété entre l'Inserm et Limagrain. »
Source : Le Monde du 07/03/1997.
Voilà un problème médical d'importance à résoudre et voici une solution transgénique : on peut transférer des gènesgènes de l'hémoglobine humaine dans un plant de tabac grâce à une bactérie. Ceci permet ensuite la synthèse d'hémoglobine par les cellules du plant de tabac.
Le fer et les végétaux
Le fer est concerné en tant qu'élément métallique indispensable, l'acquisition du fer du sol par les plantes permet son entrée dans la chaîne alimentairechaîne alimentaire. Les plantes peuvent être divisées en graminéesgraminées et en non-graminées qui n'utilisent pas les mêmes moyens pour acquérir le fer du sol. Une fois entré dans la racine, le fer est acheminé vers les parties aériennes sous forme de complexe Fe III par la sève ascendante circulant dans le xylèmexylème. Une fois délivré dans les chloroplasteschloroplastes, le fer est distribué par des mécanismes encore non élucidés.
Le fer peut être toxique en raison de sa grande réactivité avec l'oxygène. Il doit donc être tamponné par les ferritines des plastes. La réaction de photosynthèsephotosynthèse nécessite plusieurs protéines Fe-S. La biogenèse de ces groupements est présente dans les mitochondriesmitochondries de plantes comme chez la levure de bièrelevure de bière mais aussi dans les chloroplastes, indiquant que ces organitesorganites spécifiquement végétaux posséderaient une certaine autonomieautonomie pour cette utilisation particulière du fer.
Découverte d'un nouveau gène responsable de l'absorption du fer par les céréalescéréales : une équipe du laboratoire de BiochimieBiochimie et Physiologie Moléculaire des Plantes à Montpellier (CNRS, INRA, Agro-M, UM II), en collaboration avec une équipe américaine, vient de réaliser une première en caractérisant le gène ys1 de maïsmaïs, impliqué dans la nutrition de la plante en fer (Nature du 18 janvier 2001). Chez les graminées, telles que le maïs, l'absorption du fer se fait en deux étapes : la plante sécrète dans le milieu extérieur les phytosidérophores, qui forment un complexe avec le fer III dans le sol.