au sommaire
Découvrez ici quels sont les mineraisminerais de fer : limonite, goethite, hématitehématite, etc. Découvrez également les principes de la métallurgie du fer.

La goethite est un minerai de fer. Ici, des cristaux de vanadinite (rouge) sur goethite. © Parent Géry, Wikipédia, CC by-sa 3.0
Pour les minerais les plus courants, des composés donc, on a :
- la limonite : un mélange d'oxydes et d'hydroxydes de fer plus ou moins hydratés dont la goethite. La limonite est souvent présente dans des roches d'origine magmatique ou métamorphique. Mélangée à de l'argileargile elle donne des ocresocres plus ou moins jaunes. Attention : le terme hématite brune est synonyme de limonite et non d'hématite.
- la goethite : FeO-OH.nH2O orthorhombique, cristallisée en prismes courts, lamelles ou concrétionsconcrétions. C'est donc un oxyde dans lequel le pourcentage de fer peut dépasser 60 %. Sa densité est de 3,96, sa dureté Mohs de 4. De couleur noir brillant sous forme cristallineforme cristalline, elle est de couleur brun jaune sous forme terreuse. On la trouve en couche, en chapeau de ferchapeau de fer et dans les latériteslatérites.
- l'hématite : Fe2O3 rhomboédrique, ses formes de cristallisation dépendent de la température de solidification. C'est aussi on oxyde qui contient jusqu'à 73 % de fer. De densité 5,26 de dureté 6, elle est gris brillant sous forme cristallisée (on en fait des perles) et brun rouge sous forme terreuse. L'hématite est le minerai de fer type : sous forme anhydre, elle prend le nom d'oligiste (ou hématite rouge) ; sous forme hydratée, elle prend le nom de limonite (ou hématite brune). On la trouve dans des veines, des couches et dans les chapeaux de fer. Les chapeaux de fer ou gossans correspondent à des formations rougeâtres constituées par des oxydes de fer et des hydroxydes résultant de l'altération des sulfures par les eaux de surface selon la réaction : 2 FeS2 + 7,5 O2 + 8H2O + CO2 -> 2Fe(OH)3 + 4H2SO4 + H2CO3

Concrétions d'hématite.
Ces acidesacides facilitent la dissolution et le phénomène s'accentue. Dans le cas d'un gisementgisement polymétalliquepolymétallique seul le fer est insoluble et s'accumule sur place. Les autres métauxmétaux forment un horizon enrichi, plus bas dans la zone de cémentationzone de cémentation parce qu'ils sont emportés par lessivage. Les chapeaux de fer sont en général plus durs et plus résistants que les roches encaissantes et finissent par former un relief.
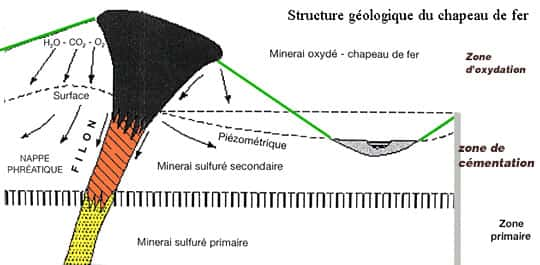
Le chapeau de fer.
Magnétite, sidérite et pyrite
Citons encore dans les minerais :
- la magnétitemagnétite : Fe3O4 contient 70 % de fer,
- la sidéritesidérite : FeCO3 un carbonate, en contient 48 % ;
- la pyritepyrite : elle peut contenir 46 % de fer.

Sidérite.
Il y a naturellement d'autres composés naturels du fer qui ne sont pas forcément des minerais intéressants, parmi lesquels il faut mentionner les silicatessilicates, le fer étant présent dans tous les minérauxminéraux basiques : pyroxènespyroxènes, amphibolesamphiboles, grenats, olivineolivine, micas, épidotes.

Pyrite.
Il y en a bien d'autres encore, comme des alliagesalliages naturels par exemple les météoritesmétéorites alliages de fer et de nickelnickel.
L'ocre est un nom général pour une terre contenant du fer mais la couleur change selon le composé présent : rouge pour l'hématite, brune pour la limonite et jaune pour la goethite...

Météorite coupée.
La fougérite
L'Inra a mis en évidence un nouvel oxyde de fer : la fougérite. Découvert dans les sols de la forêt de FougèresFougères, en Ille-et-Vilaine, il a obtenu son homologation par l'Association Internationale de Minéralogie en 2004.
La couleur bleu-vert de certains sols, virant au jaune au contact de l'airair est utilisée depuis 1905 comme critère universel de reconnaissance des gleys, sols gorgés d'eau et réducteurs. Présents sous tous les climatsclimats, ils sont difficiles à valoriser. En 1996, les chercheurs du centre INRA d'Avignon, en collaboration avec le CNRS et l'Université Henri PoincaréHenri Poincaré de Nancy, ont pu montrer que le minéralminéral naturel donnant leur couleur aux gleys appartient aux " rouillesrouilles vertes ". Il a fallu étudier à la fois la qualité des eaux du sol, les réactions chimiquesréactions chimiques solidessolides - solutions, et les formes solides du fer dans le sol. L'approche pluridisciplinaire, combinant la science du sol, la géochimie, la minéralogie, la cristallographiecristallographie, la physiquephysique du solide et la modélisationmodélisation thermodynamiquethermodynamique, a permis de montrer que dans le sol, la fougérite est le principal intermédiaire cristallin entre le fer II, soluble, et le fer III, insoluble. Indicateur très sensible des conditions d'aérobiose / anaérobiose, la fougérite de couleur bleu-vert se transforme en lépidocrocite ou en goethite, de couleur ocre s'il y a de l'oxygèneoxygène. Elle peut, de plus, limiter la dénitrification par compétition avec le nitrate pour la respiration des microorganismesmicroorganismes aérobiesaérobies facultatifs ou anaérobies, ou par réduction directe en ammonium. Elle agit aussi sur des métaux polluants, comme Cu, Zn, Ni.
Pour plus d'informations : Inra : F. Trolard-Stoll, [email protected] et G. Bourrié, [email protected].
Métallurgie du fer : principes
Le grillage du minerai permet d'obtenir un oxyde de fer débarrassé des impuretés qu'on y trouve généralement (soufresoufre, phosphorephosphore et eau). Voici une réaction qui se produit pendant le grillage :

Minerai brut : goethite.
On voit très bien la modification du minerai pendant le grillage, ces deux photos (au-dessus et en dessous) étant prises sur les mêmes cailloux. À la place du grillage, et pour certains minerais, on fait une calcination dont voici la réaction :

Minerai grillé.
Il faut ensuite réduire l'oxyde pour obtenir du fer métallique selon la réaction générale en métallurgie :
où MO est l'oxyde métallique, CO le monoxyde de carbonemonoxyde de carbone qui sert de réducteur, M le métal réduit donc sous forme métallique utilisable.
Soit pour le fer :
Cette réaction se produit vers 1.200 °C.
D'autre part dans la colonne de chauffe se produit une oxydationoxydation de l'hématite qui donne de la magnétite laquelle sera transformée en scoriescorie et fer métallique selon les proportions suivantes :
soit, stoechiométriquement une quantité de fer métallique égale à la moitié de la quantité de fer présente dans la scorie ! Il vaut donc mieux avoir un minerai riche en fer - une teneur d'au moins 50 %.
Donc, après le grillage et concassage, on peut enrichir le minerai en le triant avec un aimantaimant, par exemple.
Pour le détail, la transformation en fer se fait selon les étapes suivantes :
Fe2O3 forme α à 400 °C - hématite -> Fe2O3 forme γ à 450 °C - maguénite (aimantée) -> Fe3O4 à 700°C - magnétite (aimantée) -> FeO à 850°C - wüstite -> Fe-C métal à 1.200-1.300 °C
Pour réussir cette transformation il faut une colonne de four de 1,2 mètre, au moins, de haut, d'où la constructionconstruction de 1,5 m pour le bas-fourneau de la page suivante.
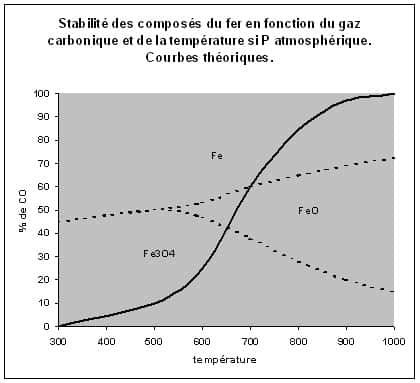
Diagramme stabilité Fe-CO.
Le diagramme ci-dessus montre les zones de stabilité des différents composés du fer en fonction de la composition de l'atmosphèreatmosphère plus ou moins riche en monoxyde de carbone dans un fourneau.