au sommaire
Cyclooxygenases et inflammation
La [cyclooxygénase] (COX) ou prostaglandineprostaglandine G/H synthase (EC 1.14.99.1.)) (Copeland R.A. et al., 1994) a un rôle essentiel dans la cascade de l'acide arachidonique. En effet, c'est elle qui est responsable de la synthèse des différents médiateurs chimiquesmédiateurs chimiques que sont les prostanoïdes et les thromboxanes. Ces métabolitesmétabolites sont impliqués dans la transmission des informations entre les cellules et notamment ils sont à l'origine des processus inflammatoires. Ces phénomènes de lutte de l'organisme contre une éventuelle agression extérieure peuvent devenir néfastes dans les cas où leur action trop importante conduit à une dérégulation de l'organisme.
2.2.1. STRUCTURE DES CYCLOOXYGENASES
2.2.1.1. La [cyclooxygénase]-1
La [cyclooxygénase]-1 ([COX-1]) a été découverte en 1971 et s'est vu attribuée à ce moment l'explication de l'action biochimique des anti-inflammatoiresanti-inflammatoires non stéroïdiens (Vane J.R., 1971).
A cette époque, il a été constaté que les composés appartenant à la même classe que l'aspirineaspirine avaient la propriété de diminuer la production de prostaglandines; cette inhibitioninhibition a tout logiquement été attribuée à une action sélective sur la [COX-1] (Smith J.B. et Willis A.L., 1971). Avec la découverte de la [cyclooxygénase]-2, cette hypothèse a par la suite été réfutée.
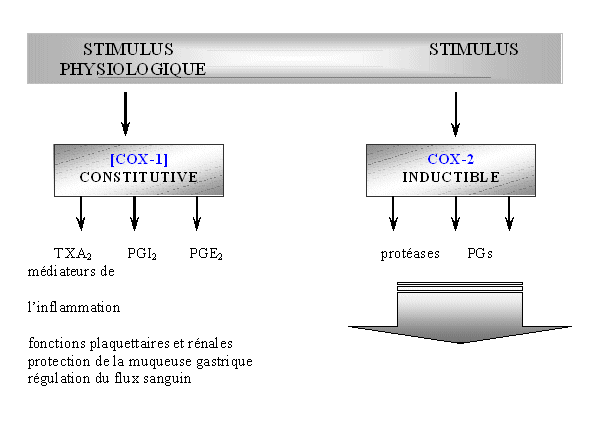
La [cyclooxygénase]-1 est une enzyme bifonctionnelle, c'est à dire qu'elle est capable dans un premier temps de convertir l'acide arachidonique en endoperoxyde cyclique (PGG2), c'est la fonction [cyclooxygénase]. Puis, ce premier produit est transformé en PGH2 par la fonction peroxydase de l'enzyme (De Witt, 1991).
La [COX-1] est codée par un gènegène du chromosomechromosome IX, le promoteur de ce gène codant pour la [cyclooxygénase]-1 ne contient pas de TATA box impliquant que cette enzyme ne soit pas régulée d'où son caractère constitutif, bien que certaines études ont mis en évidence une augmentation de la quantité d'enzyme de 2 à 4 fois supérieure dans certains tissus (Oshima TT. et al., 1991). Cette protéineprotéine est hautement exprimée dans les plaquettes sanguinesplaquettes sanguines (Funck C.D. et al., 1991), dans les cellules endothéliales vasculaires (Goppelt-Struebe M., 1995), dans l'estomacestomac (Smith W.L. et al., 1994) et dans les reinsreins (Seibert K. et al., 1994).
La [cyclooxygénase]-1 est une protéine de 71 kDa composée de 576 acides aminésacides aminés, par ailleurs c'est une hémoprotéine et une glycoprotéineglycoprotéine fixée à la membrane. Sa structure tridimensionnelle est composée de trois domaines distincts : un domaine EGF-like formé de deux doubles feuillets β, un domaine de liaison à la membrane composé de quatre hélices α dans lequel viendra se loger l'acide arachidonique ou les Anti-Inflammatoires Non Stéroïdiens (AINS) et d'un domaine catalytique bifonctionnel. Le site actifsite actif est composé d'acides aminés essentielsacides aminés essentiels en raison de leurs groupements fonctionnels ou par leurs positions spatiales : l'acide glutamiqueacide glutamique 324 permet l'ionisation de l'argininearginine 120, cette arginine 120 permet la liaison de certains AINS ou de l'acide arachidonique grâce à leur fonction acide carboxylique terminale, la sérinesérine 530 sera acétylée lors de la liaison de l'enzyme à l'aspirine, la tyrosinetyrosine 385 est essentielle pour l'activité catalytique dioxygénase et la tyrosine 355 constitue avec l'arginine 120 un rétrécissement du canal hydrophobehydrophobe dans sa zone médiane (fig. 40). Des modifications post-transcriptionnelles ont également été relevées, en effet, les asparaginesasparagines 410, 144 et 68 sont N-glycosylées et ces sucressucres sont indispensables pour que l'enzyme soit sous sa conformationconformation active (Picot et al., 1994).
Les prostaglandines synthétisées par la [COX-1] sont trouvées dans de nombreux tissus et ont des fonctions diverses comme d'être anti-thrombotique ou cytoprotectrice (Greyn J. et al., 1998). Par exemple, il est possible de citer le rôle cytoprotecteur de ces prostaglandines au niveau de la muqueusemuqueuse gastrique, dans le maintien du flux sanguin au niveau rénal, ou dans le maintien de l'homéostasiehoméostasie vasculaire (Reitz D.B. et Isakson P.C., 1995).
2.2.1.2. La [cyclooxygénase]-2
La [cyclooxygénase]-2 (COX-2) a été découverte en 1990 et elle a été rapidement associée aux phénomènes inflammatoires pouvant toucher l'organisme. Elle a été mise en évidence après que certaines études aient prouvé que la quantité de protéines COX augmentait dans les états inflammatoires, suggérant la présence d'une forme inductible de la [cyclooxygénase] (Raz A. et al., 1988).
La COX-2 a de fortes homologieshomologies avec la COX-1 : 60% des acides aminés, au nombre de 604 (Hla T. et Neilson K., 1992), sont identiques d'où une masse moléculaire également de 71 kDa, de plus certaines régions protéiques sont conservées, en particulier les sites catalytiquessites catalytiques (cyclooxygénase et peroxydase) et le site de reconnaissance contenant le noyau héminique (Xie W. et al., 1991). Les N-glycosylations relevées sur COX-1 sont aussi présentes mais un autre site est concerné : l'asparagine 80 qui est glycosylée sur 50% des protéines, son rôle n'est pas défini (fig.41).
Les principales différences entre les deux isoenzymes sont la présence d'une extension du côté C-terminal sur [COX-2] et le site de liaison aux AINS plus grand, ceci est possible par la substitution d'une valinevaline par une isoleucineisoleucine en position 523 entraînant la délétiondélétion d'un groupement méthylène ce qui permet l'accès à une poche supplémentaire dans le site actif de l'enzyme (Kurumbail R.G. et al., 1996).
C'est cette zone qui devrait être reconnue par les inhibiteurs sélectifs de cyclooxygénase-2. Les propriétés enzymatiquesenzymatiques (Vmax, Km ...) sont également comparables.
Le gène codant pour [COX-2] présente de nombreux facteurs de transcriptiontranscription (TATA box, GC box pour fixer la protéine Sp1, site de fixation à NF-B ...), l'ARNmARNm correspondant possède une région non traduite en 3' qui contient de nombreux signaux de polyadénylation (Kraemer S.A. et al., 1992).
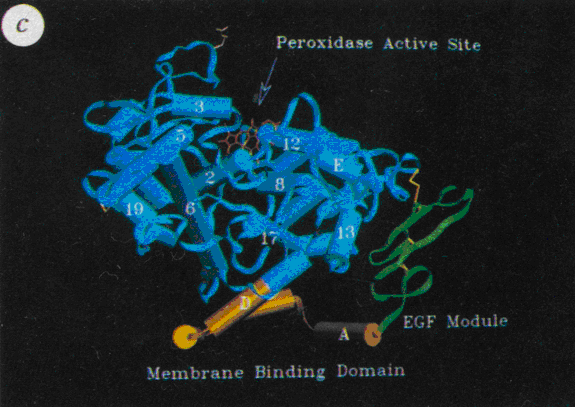
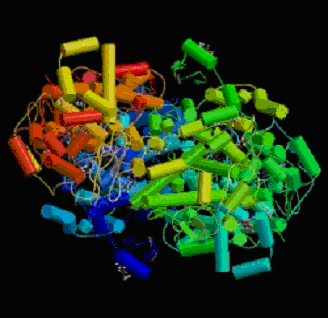
Fig. 40 :Représentation en cristallographie de la cyclooxygénase-1 (Picot et al., 1994).


Fig. 41 : Représentation en cristallographie de la cyclooxygénase-2
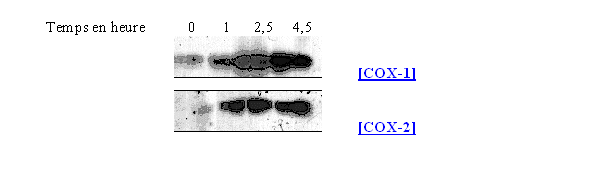
La [COX-2] n'est pas exprimée en temps normal dans la pluspart des cellules, cette expression se fait dans des cellules liées à l'inflammationinflammation comme les monocytesmonocytes ou les fibroblastesfibroblastes et sous l'action de cytokinescytokines comme IL-1β, TNF-α, IFN γ, d'endotoxineendotoxine bactérienne, de facteurs de croissancefacteurs de croissance ou d'estersesters de phorbol. Ceci a pour conséquence d'induire de façon immédiate la transcription et la traduction de [COX-2], mais en quelques heures la protéine est dégradée (Patrignani P. et al., 1994).
Cette synthèse de COX-2 entraîne la production de prostaglandines et de thromboxanes. La transcription de cette enzyme peut être bloquée par les corticoïdescorticoïdes (Masferrer J.L. et al., 1992).
2.2.2. METABOLISME DE L'ACIDE ARACHIDONIQUE
2.2.2.1. Cascade de l'acide arachidonique
Il existe plusieurs voies métaboliques différentes à partir de l'acide arachidonique. Sous l'action de la lipooxygénase, celui-ci sera transformé en leucotriènes B4, C4, D4 E4 acide 15-S-hydroxyeicosatétraénoïque (15-S-HETE) et en lipoxines A4 et B4.
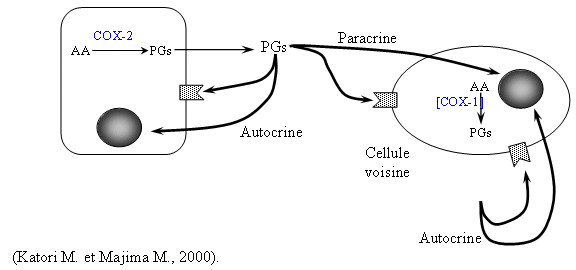
Une autre voie est celle des époxygénases (cytochromecytochrome P-450) qui entraîne la formation d'acides époxyéicosatriénoïques. Les métabolites produits envoient des signaux aux cellules adjacentes de façon paracrine ou pour stimuler la cellule émettrice de façon autocrine (fig. 42). La faible portée de ces signaux est attribuée à la courte duréedurée de vie de ces eicosanoïdes

Fig. 42 : Schéma montrant les prostanoïdes comme médiateurs biologiques
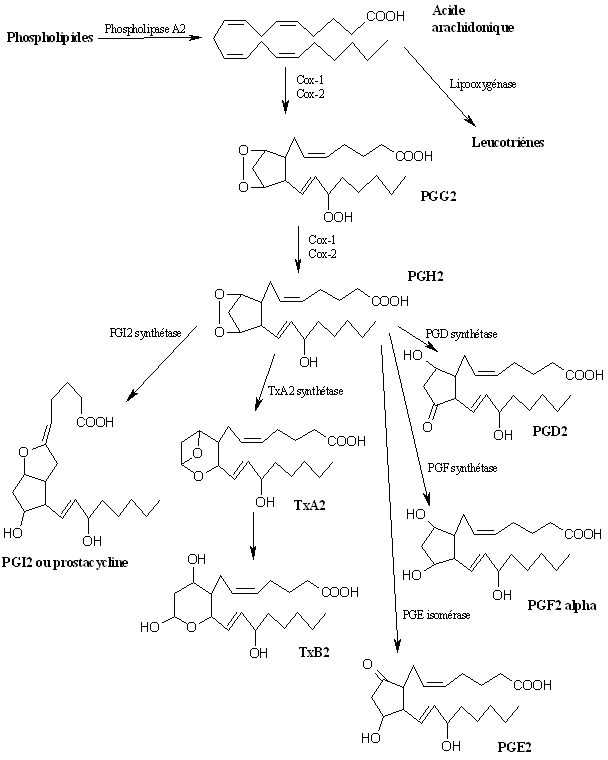
fig. 43 : Cascade de l'acide arachidonique
La voie qui nous intéresse est celle de la cyclooxygénase qui conduira à la production de divers prostanoïdes et thromboxanes (fig. 43). L'acide arachidonique est libéré des membranes plasmiquesmembranes plasmiques sous l'action de la phospholipase A2 sur la phosphatidylcholine (Tomlinson A. et al., 1994).
Ensuite, la cyclooxygénase transforme l'acide arachidonique sur deux sites distincts et en deux étapes successives. Comme nous l'avons déjà vu, la première étape est une dioxygénation permettant la formation de PGG2, la seconde est une peroxydation qui transforme la PGG2 en PGH2.
La PGH2 est hautement instable, et son isomérisation ou réduction permet la production de divers métabolites. Sous l'action de la PGI2 synthétase, il se forme la PGI2 ou prostacycline, la TxA2 synthétase conduit à la formation du thromboxane A2 (TxA2) dont la demi-viedemi-vie est de l'ordre de la seconde et qui rapidement modifié en thromboxane B2 (TxB2). La PGH2 est également à l'origine de la formation de la PGD2 sous l'action de la PGD synthétase, de la PGF2α par la PGF synthétase et de la PGE2 par la PGE isoméraseisomérase (Kuehl F.A. et Egan R.W., 1980). Ce sont ces différents métabolites finaux qui auront un rôle à jouer dans diverses fonctions de l'organisme.
.2.2.2.2. Structure et rôle des prostanoïdes
Les prostaglandines sont des médiateurs biologiques, impliquées dans des processus physiologiques normaux comme le maintien de l'intégritéintégrité de la muqueuse gastrogastro-intestinale (contrôle de la sécrétionsécrétion gastrique, du flux sanguin de la muqueuse gastrique, de la production de mucusmucus gastrique) mais également des processus pathologiquespathologiques comme l'inflammation, la fièvrefièvre, la douleurdouleur et la polyarthrite rhumatoïde (Kargman S. et al., 1996) (fig. 44).
Les fonctions différentes des prostanoïdes sont dues aux types et sous-types de récepteurs existant, pour la PGE2, ses multiples actions sont expliquées par la grande diversité des sous-types de récepteur auxquels elle peut se fixer (Coleman R.A. et al., 1994).
Les modes d'action des eicosanoïdes, qui modulent finement les fonctions cellulaires, peuvent être classés en trois catégories. La première est une action directe : la dilatationdilatation des artériolesartérioles et une inhibition de l'agrégation plaquettaire par la PGI2, l'agrégation plaquettaire par le TxA2, la contraction des muscles lissesmuscles lisses des bronchesbronches et des artérioles est induite par le leucotriène C4.
La deuxième est une potentialisation d'action : la PGE2 et la PGI2 potentialisent l'activité de l'histaminehistamine, de la substance P et de la bradykinine en augmentant la perméabilité vasculaire, la douleur produite sous l'action des prostaglandines concernées est négligeable mais elles sensibilisent la terminaison nerveuse permettant une augmentation de la douleur par la bradykinine.
La troisième est une action de rétrocontrôle : dans les tissus où est présente l'inflammation, il y a production de la PGE2 par l'intermédiaire de cytokines comme TNF-α, IL-1 et IL-6. La PGE2 présente induit un rétrocontrôle négatif de la sécrétion de TNF-α et IL-1, tandis qu'une boucle de rétrocontrôle positif augment le relargagerelargage de IL-6. La PGE2 serait capable de supprimer la production de noradrénalinenoradrénaline par les terminaisons des nerfsnerfs sympathiques périphériques (Utsunomiya I. et al., 1994).

Fig. 44 : Implications possibles des prostaglandines et thromboxane produits à partir de l'acide arachidonique
Un autre élément permet de confirmer que les eicosanoïdes ont divers effets sur les fonctions cellulaires, certains métabolites ont des effets opposés. En effet, le TxA2 et la PGI2 ont des propriétés antagonistes.
Le premier permet une vasoconstriction, et l'agrégation plaquettaire tandis que le second induit une vasodilatationvasodilatation et une inhibition de l'agrégation plaquettaire.
Ceci prouve que la régulation des fonctions cellulaires est dépendante de l'équilibre existant entre les différentes concentrations en eicosanoïdes (Greyn J. et al., 1998).
2.2.3. ETATS PATHOLOGIQUES IMPLIQUANT LA CYCLOOXYGENASE-2
Du fait des possibilités d'action des prostanoïdes et des dérivés, il est logique de penser qu'ils peuvent être impliqués dans divers dérèglements physiologiques plus ou moins graves. Ces actions néfastes vont être explicitées en essayant de mettre en évidence les causes et les effets des métabolites de l'acide arachidonique.
2.2.3.1. La polyarthrite rhumatoïde
La polyarthrite rhumatoïde est caractérisée par une réponse inflammatoire trop importante de l'organisme entraînant une destruction du cartilagecartilage et apparition de la douleur. Des études in vivoin vivo, chez le rat, ont montré que le déclenchement de symptômessymptômes similaires à la polyarthrite rhumatoïde, provoquait une augmentation de la quantité de TNF-α et de IL-6 qui est suivie d'une production de COX-2 au niveau de l'œdèmeœdème.
Après administration d'inhibiteurs sélectifs de COX-2, ces marqueurs de l'inflammation se retrouvent à leur niveau basalbasal en même temps que la disparition de l'œdème (Anderson G.D. et al., 1996).
Un autre moyen de diminuer les effets de l'inflammation est d'administrer un anticorpsanticorps anti-PGE2, ce qui a pour effet de provoquer une réversionréversion de l'œdème accompagnée d'une diminution de la quantité de IL-6 (Protanova J.P. et al., 1996).
D'autres études, réalisées sur des cellules endothéliales isolées provenant de patients atteints de polyarthrite rhumatoïde, ont montré une présence importante de cyclooxygénase-2. Ceci est à comparer avec les même cellules provenant de personne non atteintes de polyarthrite rhumatoïde où cette même enzyme est absente (Kang R.Y. et al., 1996).
2.2.3.2. L'angiogénèse
Les prostaglandines sont impliquées dans les voies de transductiontransduction conduisant à la prolifération cellulaire dans les cellules endothéliales vasculaires. Lors de la prolifération cellulaire anarchique, il a été remarqué que le volumevolume des microvaisseaux sanguins augmentait lorsque l'on ajoutait de l'EGF ou du « basic fibroflast growth factor », cette augmentation est suivie d'une production accrue d'hémoglobinehémoglobine et de COX-2. La quantité d'hémoglobine diminue lorsqu'un inhibiteur de la cyclooxygénase-2 est administré, ce qui montre l'impact de cette enzyme sur la prolifération cellulaire (Majima M. et al., 2000).
2.2.3.3. L'absorption osseuse
Les prostanoïdes sont responsables de l'hypercalcémiehypercalcémie de malignité ou des maladies inflammatoires osseuses. En effet, ces métabolites, en particulier PGE2, sont des agonistesagonistes potentiels impliqués dans la stimulationstimulation ou l'inhibition de la résorptionrésorption ou de la formation osseuse (Kawaguchi H. et al., 1995). La présence de l'IL-1 induit la synthèse de COX-2, alors que COX-1 reste indétectable, dans les ostéoblastesostéoblastes conduisant à la formation de PGE2 (De Brum-Fernandes A.J. et al., 1994). Ce dernier agit de manière autocrine en utilisant les récepteurs du sous-type correspondant à la PGE2 permettant ainsi la transformation des cellules en ostéoclastesostéoclastes qui sont impliquées dans l'absorptionabsorption osseuse (Suda M. et al., 1998).
2.2.3.4. Le cancer du colon
Des études épidémiologiques ont pu mettre en évidence qu'une prise régulière d'AINS permettait de réduire la croissance des tumeurstumeurs du colon (Heath C.W. et al., 1994).
Afin d'expliquer ce phénomène, des recherches ont été menées pour comprendre le rôle des AINS dans ce cas précis. Il a ainsi été montré que la COX-2 était présente dans les trois quarts des cellules cancéreuses alors que cette enzyme est absente dans quasiment tous les tissus environnants (Kargman S.L. et al., 1995).
La COX-2 est absente des cellules épithéliales formant les polypes de l'adénomeadénome, mais elle est présente dans les cellules intestinales voisines, ce qui montre que cette protéine est directement liée à la prolifération des cellules cancéreuses (Williams C.S. et al., 1996).
D'autre part, les prostanoïdes générés par la COX-2 permettraient une surexpression de COX-2 et induiraient une résistancerésistance des cellules à l'apoptoseapoptose, cette résistance étant réduite lors de l'administration d'AINS (Dubois R.N. et al., 1996).
Les inhibiteurs de la COX-2 pourraient avoir une action bénéfique dans le cancercancer de l'œsophageœsophage (Rhonda F. et al., 1998).
Les études in vitroin vitro ont montré que dans ce type de cancer une surexpression de la COX-2 induisait une diminution de l'apoptose et une augmentation de l'invasion par les cellules malignes. Plusieurs enquêtes épidémiologiques ont mis en évidence que les AINS avaient la particularité de réduire le nombre et le développement des tumeurs cancéreuses et que ceci est probablement du à une inhibition de la COX-2.
2.2.3.5. L'insuffisance rénale
La circulation sanguine au niveau des reins est régulée en partie par les prostanoïdes et leur absence provoque des effets hémodynamiqueshémodynamiques (MacMac Giff J.C. et Wong P.Y., 1979).
Dans le cas d'insuffisance rénaleinsuffisance rénale due à une rétention sodée excessive ou à des dommages au niveau vasculaire, l'emploi d'AINS peut entraîner des effets néfastes sur le flux plasmatique rénal, la filtrationfiltration glomérulaire ou l'excrétion de sodiumsodium (Nies A.S., 1988).
Il est possible de trouver la COX-2 au niveau du glomérule, dans les cellules adjacentes de la branche ascendante qui suit l'anseanse de Henlé, tandis que la COX-1 est présente au niveau du glomérule et du tube collecteur. Le niveau d'expression de COX-2 varie selon la concentration en sel, en effet, lors d'un régime salé la quantité de COX-2 diminue tandis que le maximum de COX-2 est obtenu lors d'un régime sans sel (Yang T. et al., 1998). Le rôle de la PGE2 produit par COX-2 est de réguler la synthèse d'une protéine : la rénine, impliquée dans l'angiogénèse (Harding P. et al., 1997).
2.2.3.6. L'hyperalgésie
La synthèse de prostanoïdes par les cyclooxygénases permet une sensibilisation de la douleur par d'autres stimulants chimiques ou mécaniques (Ferreira S.H. et al., 1972).
Ce rôle de sensibilisation est attribué à la PGE2 et elle favorise l'action de l'un ou l'autre des stimuli en fonction du sous-type de récepteur sur lequel elle se fixe, par exemple EP3 pour la bradykinine, EP2 pour la chaleurchaleur (Kumazawa T. et al., 1996).
Le fait d'injecter un AINS permet d'annuler cet effet de potentialisation de la douleur des prostanoïdes et donc de limiter le processus d'hyperalgésie (Dirig D.M. et al., 1998).
2.2.3.7. Les maladies du système nerveux central
La fièvre est habituellement attribuée à une quantité trop importante de la PGE2 au niveau de l'hypothalamushypothalamus (Saper C.B., 1998), ceci s'accompagnant d'une quantité accrue de la COX-2.
En cas de fièvre, la COX-2 est abondamment présente dans la microgliemicroglie périvasculaire le long des vaisseaux sanguins cérébraux et dans les macrophagesmacrophages se trouvant dans la zone méningée (Breder C.D. et Saper C.B., 1996).
La COX-2 aurait également une action dans la maladie d'Alzheimermaladie d'Alzheimer. Le fait de prescrire des AINS permet de limiter un moment le déclin des capacités cognitives chez les personnes atteintes et de retarder l'apparition de la maladie dans les famille à risque (Breitner J. et al., 1995).
Néanmoins, les aires impliquant la maladie d'Alzheimer montrent une diminution de la quantité de la COX-2 et des prostanoïdes produits tandis que dans les zones préservées ces quantités sont à un taux normal (Chang J.W. et al., 1996).
2.2.3.8. Prolifération de l'inflammation et effets néfastes des AINS
Lors d'une réaction inflammatoire, il se produit une synthèse rapide de la COX-2 qui est suivie d'une production de PGE2 (Niki H. et al., 1996). Cette réaction peut être inhibée par l'emploi de corticoïdes qui bloquent la synthèse de la protéine tandis que l'emploi d'AINS conduit au blocage de l'enzyme elle-même.
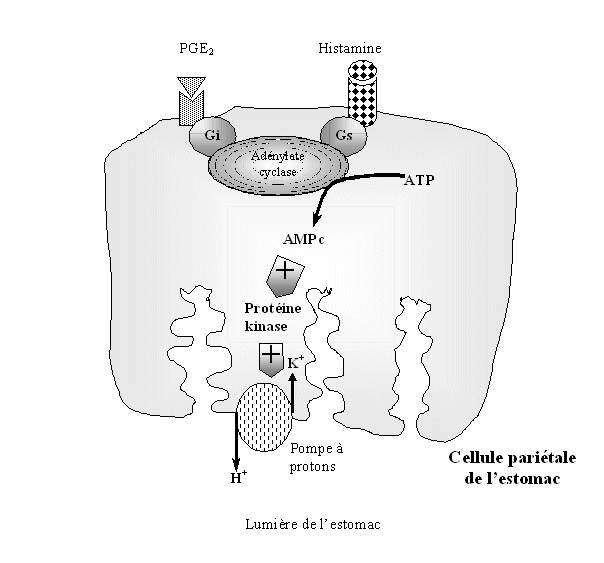
fig. 45 : Schéma expliquant les effets néfastes des inhibiteurs de la COX-2 au niveau de la parois de l'estomac.
Dans le cas de l'utilisation prolongée des AINS, des troubles au niveau de l'estomac apparaissent. La cause est la suivante : dans l'estomac la COX-1 est exprimée en quantité et de façon constitutive tandis que la COX-2 reste à un niveau faible, l'explication des effets néfastes des AINS s'explique par le fait que comme seul la COX-1 est présente, les moléculesmolécules n'ont pas le choix de la protéine à inhiber et donc seule la COX-1 est atteinte (Schmassmann A. et al., 1998).
Les cellules formant la paroi de l'estomac sont au contact de la circulation sanguine et sont capables de fixer sur leurs récepteurs soit l'histamine soit la PGE2 circulant dans le sang. La première est capable d'activer l'adénylate cyclase qui transforme l'ATPATP en AMPc qui à son tour permet la formation d'un protonproton H+ à partir de carbonate, ce proton passe ensuite la muqueuse gastrique par une pompe à protons. La PGE2 quant à elle inhibe l'adénylate cyclase, bloquant au point de départpoint de départ les sécrétions acides.
En présence d'AINS, la COX-1 est inhibée et ne peut plus produire de PGE2 en quantité suffisante, impliquant une impossibilité à bloquer l'adénylate cyclase et donc conduit à la production de protons qui passent la paroi stomacale et entraînent sa dégradation (fig.45) (Seibert K. et al., 1994).