au sommaire

Inhibiteurs de cyclooxygénases
Les AINS sont les médicaments les plus prescrits au monde pour leurs propriétés analgésiquesanalgésiques, anti-pyrétiques et anti-inflammatoiresanti-inflammatoires. Leur utilisation est tout de même limitée du fait de leurs effets secondaires en particulier au niveau du tractus gastrogastro-intestinal.
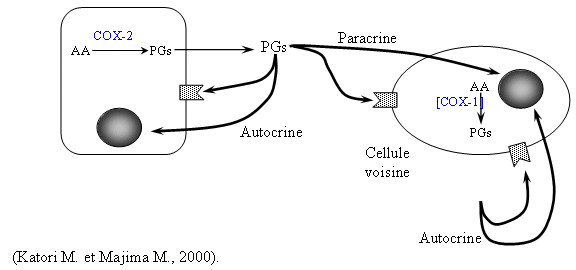
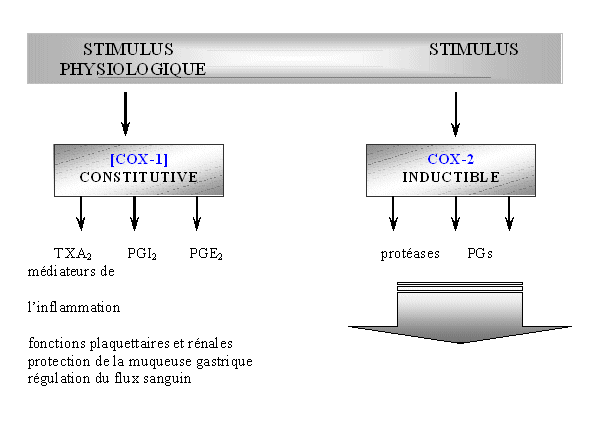
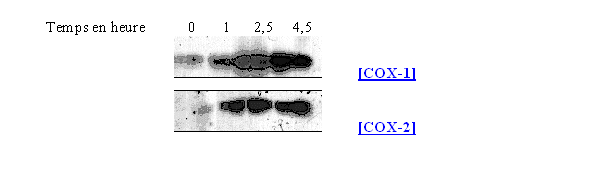
Ces composés peuvent être classés dans quatre catégories selon leurs capacités à inhiber COX-1 et COX-2 : les sélectifs (célécoxib et rofécoxib), les préférentiels (nimésulide, étodolac et méloxicam), les peu sélectifs pour COX-2 (diclofénac et piroxicam) et les mauvais inhibiteurs qui sont même de meilleurs inhibiteurs de la COX-1 par rapport à la COX-2 (la plupart des salicylates) (Katori M. et Majima M., 2000).
2.3.1. MODE D'ACTION GENERAL
Normalement, l'acide arachidonique, libéré des membranes, s'engage dans le canal hydrophobehydrophobe de la cyclooxygénase et établit une liaison avec l'Arg 120. La transformation de l'acide arachidonique en PGG2 puis en PGH2 commence alors. Les AINS peuvent également s'engager dans ce canal (fig.46) et établir une liaison avec les fonctions amines de l'Arg 120 par leur fonction acide (fig. 47). Dans ce cas, l'acide arachidonique ne peut plus s'y loger et par conséquent, la synthèse des prostanoïdes est inhibée.

fig. 46 : Représentation du canal hydrophobe de la COX-1 (Picot et al., 1994).
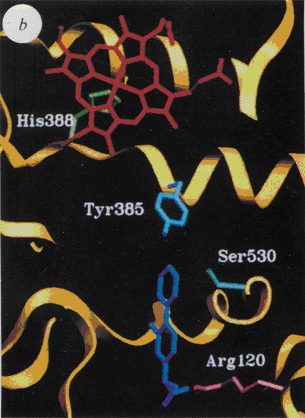
fig. 47 : Représentation du flurbiprofène avec le site actif de la COX-1 (picot et al.,1994).
Des études on été menées afin de mieux comprendre le mode de liaison entre les AINS et la cyclooxygénase. Dans le cas du flurbiprofène, des recherches en cristallographiecristallographie ont pu mettre en évidence les points de reconnaissance. Le flurbiprofène est un AINS non sélectif (fig.48) puisque les CI50 sont de 0,29 µM pour COX-1 et 2,56 µM pour COX-2 (Kurumbail R.G. et al., 1996). Le rapport de sélectivité CI50 COX-2/CI50 COX-1 est de 8,8.
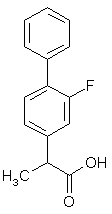
fig. 48 : Le flurbiprofène
La liaison du flurbiprofène est identique sur COX-1 et COX-2. Le flurbiprofène s'engage dans le canal hydrophobe, établit une liaison saline entre son groupement carboxylate et l'Arg 120 ainsi qu'une liaison hydrogène avec la Tyr 355. Le cycle fluorophényle forme des interactions de Van der Waals avec les atomes de la chaîne principale de la Gly 526 et de l'Ala 527. Le cycle phényle interagit avec la Ser 530, site d'acétylation par l'aspirineaspirine.
Un modèle équivalent a été développé afin d'expliciter le mode d'action de l'aspirine. L'acide acétylsalicylique fixe l'Arg 120 par son groupement carboxylique et réalise une acétylation irréversible avec la Ser 530 sur COX-1 ovine, avec la Ser 529 pour la COX-1 plaquettaire humaine et avec la Ser 516 pour la COX-2 (Picot D. et al., 1994).
Les conséquences de la fixation de l'aspirine sur COX-1 et COX-2 sont différentes. La sérinesérine acétylée provoque une saillie dans le canal hydrophobe et empêche la formation de PGG2 pour les deux isoformes. Mais, alors qu'elle provoque un blocage complet au niveau du site actifsite actif de COX-1, elle permet la biotransformation de l'acide arachidonique en 15-R-HETE par un nouveau mode de fonctionnement de la COX-2 (Terlain B. et al., 1996).
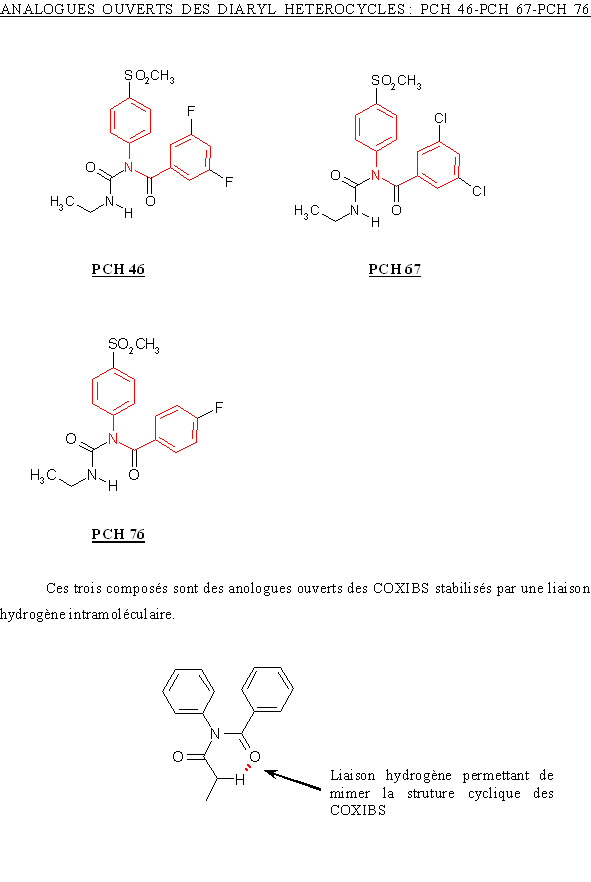
Le site actif de COX-2 est légèrement plus grand, ce qui lui permet d'accepter des molécules ayant la même structure que les AINS classiques mais avec une partie supplémentaire afin d'augmenter la spécificité vis à vis de la cyclooxygénase-2. La taille de la molécule est donc un des points sur lequel il faut jouer afin d'avoir des anti-inflammatoires sélectifs de la COX-2 (fig. 49).
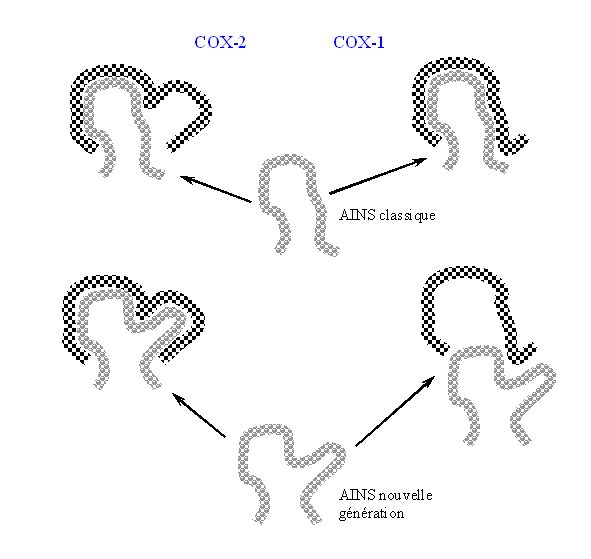
fig. 49 : Schéma permettant d'expliquer l'augmentation de sélectivité des AINS de nouvelle génération en faveur de COX-2.
2.3.2. LES INHIBITEURS PREFERENTIELS
2.3.2.1. Le nimésulide
Le nimésulide (fig. 50) a rapidement été reconnu comme un inhibiteur préférentiel de la COX-2 par rapport à la COX-1 puisqu'il inhibe la COX-2 à des valeurs 20 fois plus faibles que celles de la COX-1 (Nakatsugi S. et al., 1996).
Aux doses efficaces, il agit avec les mêmes résultats sur la douleurdouleur dans les cas de polyarthrite rhumatoïde que les AINS habituellement utilisés jusque là , mais dans le cas où l'administration est pratiquée sur du long terme, il est mieux toléré (Cullen L. et al., 1998).
Dans les cas d'inflammationinflammation limitée dans le temps comme les tendinites, les douleurs dentaires ou la fièvrefièvre, il n'y a pas de différences avec l'utilisation d'AINS classiques (Lecomte J. et al., 1994).
Plus récemment, il a été constaté que les risques de saignements au niveau du tractus gastro-intestinal ne sont pas différents de ceux causés par l'utilisation des AINS d'ancienne génération (Garcia Rodriguez L.A. et al., 1998).
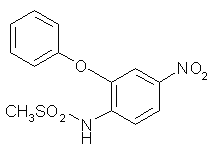
fig. 50 : Le nimésulide.
2.3.2.2. L'étodolac
L'étodolac (fig. 51) a montré dans les études in vitroin vitro une spécificité 10 fois plus forte pour la COX-2 par rapport à la COX-1 (Glaser K. et al., 1995). Les études cliniquesétudes cliniques ont montré une réelle efficacité dans les cas de polyarthrite rhumatoïde sans pour autant amener des effets indésirables (Schnitzer TT.J. et Constantine G., 1997), il est également efficace dans les cas de douleurs dues à une intervention au niveau dentaire. Ses propriétés analgésiques durent plus longtemps en comparaison avec l'aspirine (Gaston G.W. et al., 1986).
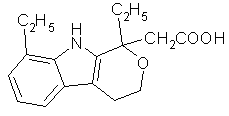
fig. 51 : L'étodolac
2.3.2.3. Le méloxicam
Le méloxicam (fig. 52) a également montré une sélectivité 3 à 12 fois plus élevée envers la COX-2 par rapport à la COX-1 dans les études in vitro (Engelhardt G., 1996, OginoOgino K. et al., 1997) et a montré in vivoin vivo chez l'animal un faible pouvoir à induire des ulcères (Ogino K. et al., 1997).
Ce médicament utilisé dans les cas de polyarthrite rhumatoïde est aussi efficace que les autres AINS sans qu'il ait été constaté d'agrégation plaquettaire et les effets secondaires au niveau gastrique sont peu nombreux (Hawkey C. et al., 1998).
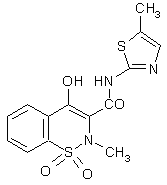
fig. 52 : Le méloxicam
2.3.3. LES INHIBITEURS SELECTIFS
2.3.3.1. Le célécoxib
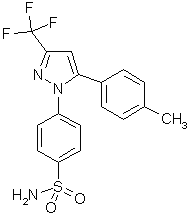
fig. 53 : Le célécoxib
Le célécoxib (fig. 53) est 375 fois plus sélectif vis à vis de la COX-2 que pour la COX-1 (Lipsky P.E., Isakson P.C., 1997, Seibert K. et al., 1994).
Il n'a pas d'effet sur l'agrégation plaquettaire, des études approfondies ont montré qu'il n'y avait pas de formation d'ulcères dans les cas d'administration prolongée. Il est employé dans des traitements de longue duréedurée comme la polyarthrite rhumatoïde ou de courte durée comme les douleurs dues à des courbaturescourbatures, des tendinites ou des douleurs dentaires (MacMac Adam B.F. et al., 1999).
2.3.3.2. Le rofécoxib
Le rofécoxib (fig. 54) est comme le célécoxib, hautement spécifique de la COX-2 par rapport à la COX-1, environ 80 fois plus sélectif (Warner T.D. et al., 1999).
Il a des propriétés anti-inflammatoires dans le traitement de la polyarthrite rhumatoïde, anti-pyrétiques et analgésiques pour des douleurs locales comme un mal de dent ou des douleurs plus généralisées. Cet effet analgésique serait même supérieur à celui produit par le célécoxib. Aucun effet secondaire n'a pu être mis en évidence (Hawkey C. et al. 2000).
fig. 54 : Le rofécoxib