au sommaire
Centre actif, site catalytique. Site particulier dans une moléculemolécule d'une enzymeenzyme où se lient les substratssubstrats et où se produit la réaction enzymatiqueenzymatique.

au sommaire
Centre actif, site catalytique. Site particulier dans une moléculemolécule d'une enzymeenzyme où se lient les substratssubstrats et où se produit la réaction enzymatiqueenzymatique.
Nos articles
à lire aussi
Santé
Génétique
dossier
• 13/03/2002

Santé
Nutrition
dossier
• 23/01/2020

Santé
Médecine
dossier
• 11/07/2024

Santé
Médecine
dossier
• 20/09/2002

Santé
Cuisine
question réponse
• 16/09/2022

Santé
Divers
question réponse
• 18/07/2017

Santé
Médecine
actualité
• 18/03/2010
Santé
Génétique
actualité
• 21/03/2013
Santé
Biologie
actualité
• 16/01/2014

Santé
Vie
actualité
• 24/02/2007

Santé
Biologie
actualité
• 20/12/2018
Santé
Génétique
actualité
• 25/06/2010

Santé
Biologie
actualité
• 12/10/2012

Santé
Médecine
actualité
• 25/05/2012
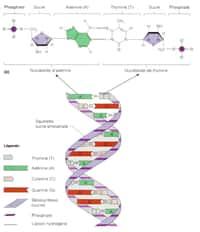
Santé
Génétique
actualité
• 10/09/2011
La sélection de la
Rédaction

Sciences
Histoire
Article

Sciences
Astronomie
Article

Sciences
Skillz
Article

Sciences
Univers
Article

Sciences
Mathématiques
Article

Sciences
Astronomie
Article

Sciences
Futura-Sciences
Article

Sciences
Astronomie
Article
Transmettre la culture
est le plus vieux métier du monde
Inscrivez-vous à la lettre d'information La quotidienne pour recevoir toutes nos dernières Actualités une fois par jour.
Toutes nos lettres d’informations