au sommaire
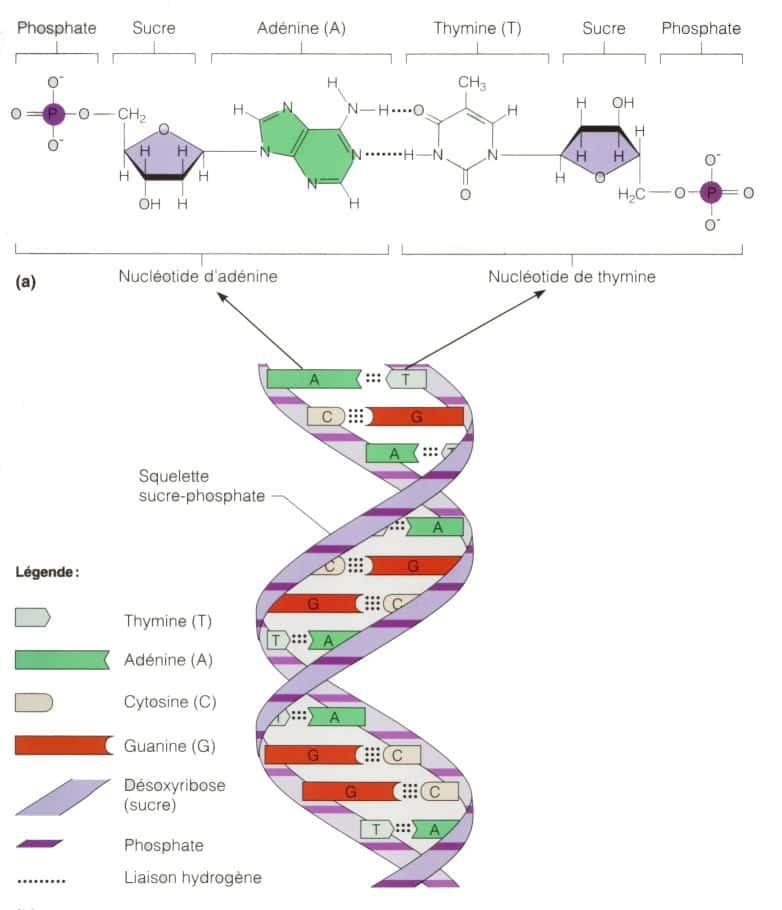
Pourra-t-on un jour maîtriser l'ADN ? © Site de biologie du réseau Collégial du Quebec
Un récent article du New Scientist fait le point sur ce qui pourrait bien être la prochaine révolution dans le domaine de la biologie synthétique. Il s'agit ni plus ni moins de domestiquer la sélection naturelle. Mais la complexité des organismes vivants est déconcertante pour les ingénieurs des nouvelles sciences comme la biotechnologiebiotechnologie. Une des caractéristiques des systèmes vivants est « l'émergenceémergence », qui fait apparaître des propriétés nouvelles et inattendues, empêchant de manipuler un système complexe de manière prévisible.
Les chercheurs en biologiechercheurs en biologie synthétique essaient d'éviter cette complexité en construisant des briques de vivant simplifiées et contrôlables. Comme le dit Drew Endy, célèbre évangéliste de la méthode des biobricks : « Les ingénieurs abominent la complexité. Je déteste les propriétés émergentes. J'aime la simplicité. Je ne veux pas que l'avion que je vais prendre demain manifeste des propriétés émergentes pendant son vol ».
Mais la technologie offre une autre option : accepter la complexité, faire comme la nature et laisser l'évolution accélérer les choses. C'est la voie défendue par George Church, professeur de génétique à Harvard et au MIT. Church a déjà fait parler de lui ces derniers temps. En 2007, il faisait dans la revue en ligne The EdgeEdge une prophétie folle pour l'époque : « Dans l'année, affirmait-il, les gens pourront consulter leur génome ». Et effectivement, onze mois plus tard, apparaissaient 23andMe et les autres sociétés de génomique personnelle. Il a ensuite créé le projet Personal Genome qui offrait aux volontaires un séquençage complet et gratuit de leur ADN à condition d'accepter de voir ses données rendues publiques. Mais c'est une autre de ses idées, celle d'une « machine à évolution », qui a retenu l'attention du New Scientist.
La bactérie E. coli a été le premier cobaye de la « machine à évolution ». © DR
Harris Wang, étudiant en troisième année de l'équipe de Church, en a inventé la première mouture en 2009. Son but était de produire une grande quantité de lycopène, la protéine qui donne sa couleurcouleur rouge aux tomatestomates. Il a donc d'abord sélectionné des bactériesbactéries E. ColiE. Coli capables de produire une petite quantité de ce produit (rappelons qu'avant de faire la Une de l'actualité sanitaire, les E. Coli étaient surtout connues pour être les « rats de laboratoirerats de laboratoire » de l'ingénierie génétique : les organismes sur lesquels on effectue tous les tests). Ensuite, il a synthétisé 50.000 brins d'ADN correspondant, avec des variations, aux 24 gènesgènes susceptibles de produire du lycopène, puis il a entré les bactéries et les brins dans sa machine, et les a laissés se recombiner joyeusement. Il a répété le cycle trente-cinq fois, produit 15 milliards de souches, l'une d'elles produisant cinq fois plus de lycopène que la bactérie originale.
On le voit ici, il ne s'agit pas de créer des mutations au hasard. On sélectionne la séquence qu'on veut améliorer et on effectue les transformations exclusivement sur celle-ci. Avec son expérience, Wang a mis trois jours pour résoudre un problème sur lequel l'industrie biotechnologique planchait depuis des années...
L'algorithme génétique appliqué au monde réel
De fait, la technique de Church n'est pas neuve. Elle s'appelle l'algorithme génétique, et a été inventée par John Holland au cours des années 1960. D'ailleurs, un grand nombre de chercheurs travaillant dans ce qu'on appelle la « vie artificielle » tentent depuis longtemps d'utiliser la sélection darwinienne pour créer des programmes informatiques de plus en plus sophistiqués. Jusqu'ici, ça n'avait pas très bien marché, et surtout, tout cela se déroulait en virtuel : les formes de vie artificielles étaient des programmes, des séquences de codes. Church, au contraire, envisage d'utiliser l'algorithme génétique dans le monde réel.
Seul problème avec cette méthode, explique le New Scientist, il est facile de produire de nouvelles configurations, mais après, il est plus difficile de les retrouver !
Pour Wang, c'était assez simple. Il a cultivé 100.000 souches et a simplement sélectionné celles qui possédaient le rouge le plus brillant. Mais ce n'est pas toujours aussi facile. Church envisage cependant des solutions au problème. On pourrait par exemple incorporer dans l'ADN à multiplier des biomarqueurs qui s'activeraient lorsqu'un certain résultat serait atteint.
Church pense vendre ses machines assez bon marché, à peu près 90.000 $ chacune. « Nous nous efforçons de faire baisser les prix pour tous, plutôt que de faire un grand projet que personne ne peut répéter », explique-t-il.
Et de se lancer, parallèlement à ses recherches, dans l'entreprise privée. Church a cofondé LS9, une société de biocarburantsbiocarburants basée près de San Francisco, et compte utiliser sa machine pour réaliser une E. coli susceptible de produire des biocarburants. Et, on le sait, la perspective de biocarburants plus faciles à produire et moins polluants est le Graal de la biologie synthétique. D'autres bactéries peuvent se révéler précieuses, telle la Shewanella, capable de convertir des métauxmétaux toxiques comme l'uraniumuranium en une forme insoluble (et donc moins dangereuse) ou les cyanobactériescyanobactéries qui peuvent extraire l'énergieénergie de la lumièrelumière grâce à la photosynthèsephotosynthèse.
Réécrire le génome ?
Mais la technologie de Church va bien plus loin. Selon lui, la machine à évolution est le seul moyen de créer de profondes transformations du génomegénome. Pas simplement quelques gènes, comme le font les ingénieurs génétiques d'aujourd'hui (et comme Wang l'a réalisé), mais la réécriture de génomes entiers.
La machine à évolution pourrait-elle réécrire des génomes entiers ? © DR
À l'heure actuelle, appliquer d'importants changements même sur le plus petit génome est extrêmement coûteux et laborieux. Ainsi, comme nous rappelle encore le New Scientist, lorsque Craig Venter a, l'an dernier, réussi à remplacer le génome d’une bactérie par son équivalent synthétique, cela lui a réclamé 400 années de travail en temps humain et a coûté autour de 40 millions de dollars.
Si la « machine à évolution » se montrait capable d'accélérer ce processus (et d'en réduire le coût), cela pourrait amener à une accélération de la manipulation du génome humain, avec toutes les questions éthiques que cela pose. Church travaille déjà dessus, à travers une recherche financée par l'Institut national américain du génome, destinée à créer une multitude de cellules humaines pour voir quelles variations pourraient être à l'origine de maladies. « Nous aimerions, explique-t-il, développer les ressources afin que les gens puissent rapidement tester des hypothèses sur le génome humain en en synthétisant de nouvelles versions. »
Par Rémi Sussan