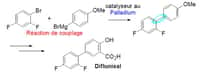
au sommaire
En chimie organique, un ester est un dérivé d'acide carboxylique. Ce composé se caractérise par un groupe fonctionnel -(C=O)-O- où le carbone porteur de la fonction, entouré de deux chaînes carbonées, est relié simultanément à un oxygène par une double liaison, à un second oxygène par une liaison simple. Le plus simple des esters est le méthanoate de méthyle, plus couramment appelé formiate de méthyle, de formule HCOOCH3.
Les esters sont très répandus dans la nature. Les corps gras, constituants des graisses animales et végétales, contiennent des fonctions ester. Très odorantes, les esters sont responsables de l'arôme des fruits et sont donc très utilisés dans l'industrie agroalimentaire et en parfumerie. Par ailleurs, les lactones, dont certains sont utilisées dans l'industrie des parfums pour leur odeur musquée, sont des esters cycliques.

Les esters entrent également dans la fabrication des plastiques, notamment des fibres polyester. © Bearas, Wikimedia Commons
Synthèse des esters
Les esters sont obtenus par estérificationestérification, action d'un acide carboxylique (ou d'un de ses dérivés) sur un alcoolalcool avec formation d'eau, soit la réaction : acide + alcool ➡️ ester + eau. Cette réaction est réversibleréversible.
C'est pourquoi le nom de l'ester comporte deux parties. L'une provient de l'acide carboxylique dans lequel on remplace la terminaison -oïque par -oate ; l'autre de la chaîne carbonée de l'alcool auquel on ajoute la terminaison -yle. Par exemple : le formiate de méthyle vient de l'acide formique (ou acide méthanoïque) et du méthanol ; le propanoate d'éthyle est issu de l'acide propanoïque et d'éthanol, etc.
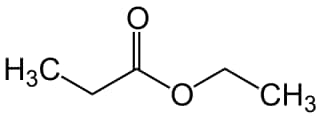
Le propanoate d’éthyle. On reconnaît la structure de l’acide propanoïque à gauche, attaché à celle de l’éthanol à droite. © Wikimedia Commons
Réactivité des esters
Les esters sont impliqués dans deux réactions majeures. L'hydrolysehydrolyse, réaction de l'ester avec l'eau, redonne l'acide carboxylique et l'alcool. C'est la réaction inverse de l'estérification. Deuxièmement, la réaction de saponifaction fait réagir des esters avec de la soudesoude NaOH. Comme le nom de la réaction l'indique, on obtient par cette méthode des savons à partir d'esters particuliers : les corps gras.