au sommaire
En chimie organique, un alcool est une molécule dont la fonction caractéristique est un groupe hydroxyle OH (un atome d'oxygène lié à un hydrogène) porté par un atome de carbonecarbone. Ce dernier détermine les différentes classes d'alcools :
- Alcools primaires : le carbone porteporte deux hydrogènes.
- Alcools secondaires : le carbone porte un seul hydrogène.
- Alcools tertiaires : le carbone n'est lié à aucun hydrogène.
Le plus simple des alcools, le méthanol (CH3-OH), figure dans une classe à part.
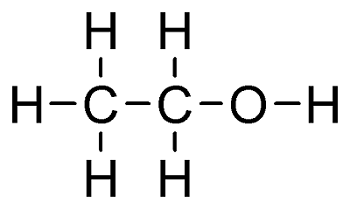
La molécule tire son nom de l'alcane dont il dérive, c'est-à-dire de la chaîne d'atomes de carbone formant le reste du composé. La terminaison -ol remplace le -e final : ainsi méthanol dérive de méthane, éthanol (CH3-CH2-OH) d'éthane, etc. Les alcools peuvent comporter un ou plusieurs groupes hydroxyle. Les diols, aussi appelés glycols, tel le méthanediol ou méthylène glycol, en ont deux ; les trialcools, comme le glycérolglycérol, trois.
L’éthanol, de formule brute C2H6O, est l’alcool le plus connu : on le consomme en boisson. © Wikimedia Commons
Le saviez-vous ?
Synthèse des alcools
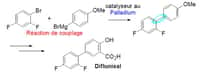
Les alcools peuvent être obtenus par hydrolysehydrolyse d'un halogénoalcane, d'un organomagnésien ou d'un esterester ; par réduction d'une cétonecétone ou d'un aldéhydealdéhyde ; ou encore par hydratationhydratation d'un alcènealcène (par exemple l'éthylèneéthylène pour l'éthanol). Cette dernière méthode est largement employée dans l'industrie chimique pour synthétiser les alcools très demandés, comme l'éthanol.
Généralement liquidesliquides, incolores, inflammables et toxiques, les alcools, en particulier l'éthanol, peuvent servir de solvantssolvants, d'antigels ou de combustiblescombustibles. L'éthanol peut aussi être consommé (avec modération) dans les boissons, qu'on appelle alors communément alcools. Le méthanol, en revanche, est toxique. L'industrie agroalimentaire les fabrique par fermentationfermentation puis distillationdistillation des végétaux, fruits ou céréalescéréales, contenant des sucressucres.
Réactivité des alcools
Les alcools sont des acidesacides faibles (car ils se dissocient difficilement dans l'eau), susceptibles de libérer un protonproton (ionion H+)) issu de la liaison -OH.
Ils jouent un rôle dans plusieurs réactions, dont certaines sont d'intérêt industriel :
- estérificationestérification : alcool + acide donne ester + eau ;
- réduction : ils donnent l'alcane correspondant, ainsi le méthanol est réduit en méthane, l'éthanol en éthane, etc. ;
- déshydratationdéshydratation : par perte d'une molécule d'eau, on obtient un alcène ;
- oxydationoxydation ménagée : selon la classe de l'alcool, on obtient un aldéhyde, un acide carboxyliqueacide carboxylique ou une cétone.