au sommaire
En chimie organique, une cétone est une molécule dont la fonction caractéristique est un groupe carbonyle C=O, c'est-à-dire un atome d'oxygène relié par une double liaison à un atome de carbone. Ce dernier est entouré obligatoirement de deux chaînes carbonées. Le composé le plus simple de cette famille est l'acétone aussi appelée propanonepropanone, de formule CH3-CO-CH3.
Le nom du composé dérive de l'hydrocarburehydrocarbure correspondant auquel on ajoute la terminaison -one. Ainsi, propanone dérive de propanepropane, butanone de butane, etc. Les cétones sont généralement liquidesliquides ou solidessolides. Elles ont un intérêt pour l'industrie en tant que solvantssolvants et colorants dans les parfums et les médicaments, et sont utilisées également dans la fabrication de plastiquesplastiques.
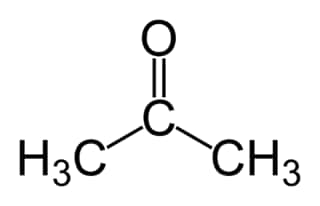
L’acétone est une des cétones les plus utilisées dans l’industrie. © Ben Mills, Wikimedia Commons
Les cétones ont des propriétés similaires à celles des aldéhydesaldéhydes, avec lesquelles il ne faut pas les confondre. En effet, un aldéhyde est un composé dans lequel le groupe C=O est porté par un carbone relié à un hydrogènehydrogène et à une chaîne carbonée.
Synthèse des cétones
Les cétones peuvent notamment être obtenues par oxydationoxydation ménagée d'un alcoolalcool secondaire à l'aide d'un puissant oxydant comme le dioxygène de l'airair, l'ionion dichromate ou encore l'ion permanganate. De même, les cétones peuvent être synthétisées à partir d'un alcool secondaire lors d'une oxydation de Jones, une réaction impliquant le réactifréactif de Jones : du trioxyde de chromechrome en présence d'acide sulfuriqueacide sulfurique.
Dans l'industrie, les cétones sont essentiellement synthétisées par oxydation des hydrocarbures par le dioxygène de l'air. C'est ainsi qu'est fabriqué le cyclohexanone, un précurseur du nylonnylon, à partir de cyclohexane. L'acétone est produite massivement à partir de benzènebenzène et de propylène en présence de dioxygène, au cours d'une série de réactions appelée procédé de cumène.
Certaines cétones, comme beaucoup d’autres composés organiques, sont utilisées dans l'industrie pharmaceutique. © PxHere
Réactivité des cétones
De par la forte polarisation de la liaison C=O, les cétones sont susceptibles de subir une addition nucléophilenucléophile sur le carbone porteur de la fonction. Cette propriété est utilisée pour protéger la fonction carbonyle par acétalisation, un procédé réversibleréversible consistant à additionner deux alcools sur le carbonyle pour former un composé inerte appelé acétal.
Certaines cétones présentent un hydrogène sur le carbone voisin de l'atome porteur de la fonction carbonyle. Elles sont alors susceptibles d'être impliquées dans une tautomérietautomérie céto-énolique, à savoir un équilibre avec un énol.