au sommaire
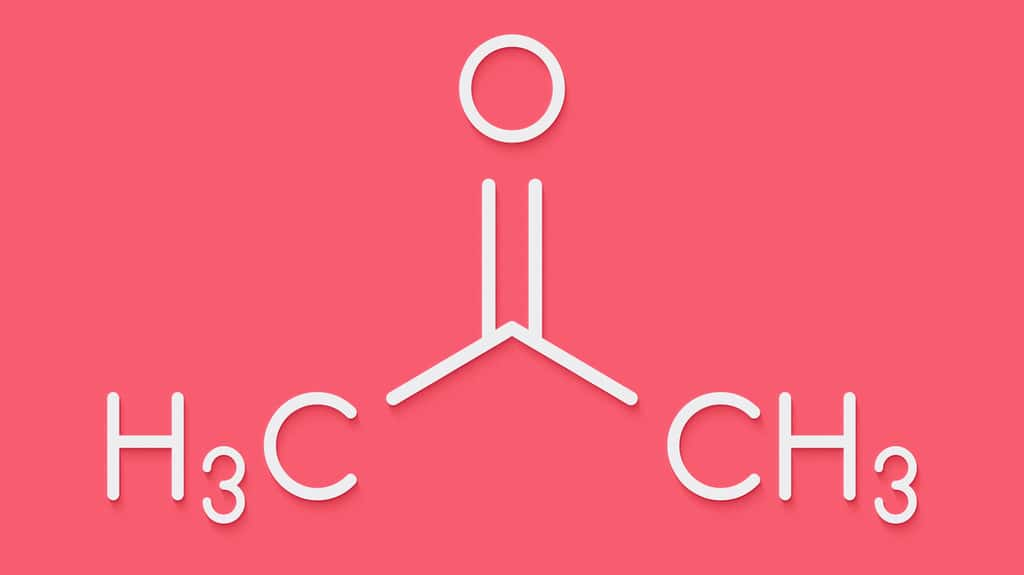
L'acétone est un liquide transparenttransparent, très inflammable et volatil, utilisé comme solvant et intermédiaire de synthèse. De formule C3H6O, il dégage une odeur caractéristique, à la fois âcre et aromatiquearomatique. Sa double liaison carbone-oxygène et la présence d'atomes d'hydrogène en position alpha (α) lui confèrent une forte réactivité à de nombreux produits. Stable dans des conditions usuelles, l'acétone peut ainsi réagir vivement avec les agents oxydantsagents oxydants puissants comme l'acideacide chromique, l'acide nitrique chaud, le permanganate de potassiumpermanganate de potassium, le péroxyde d'hydrogène, certains hydrocarbureshydrocarbures halogénés (trichlorométhanetrichlorométhane, tribromométhane...)) ou encore en présence d'une base forte (par exemple hydroxyde de sodiumhydroxyde de sodium ou de potassium). Non corrosive pour les métauxmétaux, elle attaque certaines matières plastiquesmatières plastiques.
L'acétone peut causer une sévère irritation des yeuxyeux, des nausées, des vertiges ou une somnolencesomnolence lors de l'inhalationinhalation de fortes concentrations de vapeurs (supérieures à 10.000 ppmppm).
Acétone : propriétés physiques
- Densité : 0,788 g/ml à 20 °C.
- Masse molaireMasse molaire : 58,08 g/mol.
- Point de fusionfusion : -94,7 °C.
- Point d'ébullition : 56,29 °C.
- Point d'éclairéclair : -9,4 °C.
- Température d'auto-ignition : 465 °C.
- Taux d'évaporation (étheréther=1) : 1,9.
- Limite inférieure d'explosibilité : 2,5 % à 25 °C.
- Solubilité : misciblemiscible avec l'eau, l'éthanol, l'oxyde de diéthyle, les estersesters, le benzènebenzène, le diméthylformamide, le chloroforme, la plupart des huiles.
Utilisations de l’acétone
L'acétone est l'un des solvantssolvants organiques les plus utilisés, qui dissout les gommes, résines, dérivés de cellulosecellulose, graisses, huiles et caoutchoucscaoutchoucs. Elle est utilisée dans de nombreuses formulations :
- peinture, vernisvernis, laque ;
- décapant et diluant à peintures ;
- colle et adhésifs ;
- encre, teintures et leurs diluants ;
- transport et le stockage de l'acétylène en bouteille de gazgaz comprimé.
Dans l'industrie chimique, l'acétone intervient dans de nombreux procédés :
- fabrication de produits pharmaceutiques et cosmétiques (ex. : vitamine Cvitamine C, métamphétamine) ;
- extraction des gras, huiles et cires ;
- purification des sucressucres et des amidonsamidons (agent de précipitation) ;
- purification de la paraffine ;
- nettoyage et séchage de la verrerie en laboratoire ;
- nettoyage et séchage des pièces électroniques ;
- milieu réfrigérant en mélange de glace carboniqueglace carbonique ;
- fabrication de Plexiglas (polyméthacrylate de méthylepolyméthacrylate de méthyle) ;
- fabrication de bisphénol A ;
- fabrication de poudres explosives ;
- fabrication et filage des fibres d'acétate de cellulose (ex. : colle à papier, bases de films photographiques, fibres synthétiques, rayonne, soie artificielle, viscose) ;
- fabrication d'objets en résine renforcée de fibres de verre.
Acétone et environnement
Diverses activités peuvent dégager de l'acétone dans l'atmosphèreatmosphère :
- gaz d'échappement ;
- combustioncombustion du boisbois et de déchetsdéchets ;
- dégradation des déchets dans les sites d'enfouissement ;
- industrie papetière ;
- fumée de cigarette.
L'acétone peu aussi émaner des panneaux de particules, des tapis ou certains revêtements. Elle provient également de sources naturelles lors des incendies de forêt ou des éruptions volcaniqueséruptions volcaniques.
L’acétone en biologie
L'acétone est naturellement produite et excrétée dans l'organisme au cours des processus métaboliques, notamment lorsque l'alimentation est insuffisante (jeûne, régime cétogène) ou dans les pathologies diabétiques (hypoglycémiehypoglycémie). Le corps dégrade alors des acides grasacides gras sous forme de corps cétoniques. L'excès d'acétone se manifeste par une odeur caractéristique de l'haleine et une forte concentration dans les urines. Si l'acétone s'accumule en trop grande quantité, elle entraîne une acidocétose, une acidification toxique du sang pouvant entraîner un comacoma.
























