au sommaire
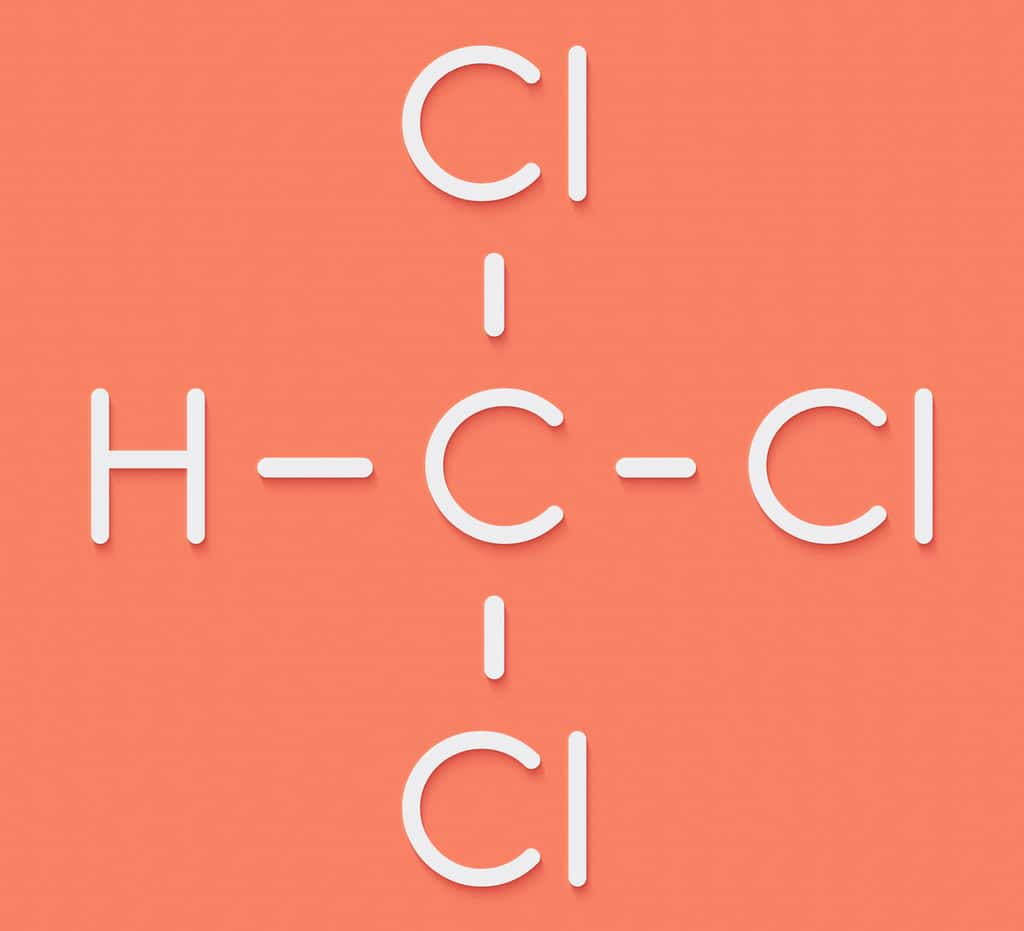
Le chloroforme (ou trichlorométhane) est un hydrocarbure halogéné ayant pour formule brute CHCl3. Il a été découvert quasi simultanément par Samuel Guthrie (États-Unis), Justus von Liebig (Allemagne) et Eugène Soubeiran (France) en 1831. Il se présente comme un liquide incolore et très volatil avec une odeur éthérée caractéristique.
Le chloroforme dans l’environnement
Le chloroforme a tendance à s’échapper dans l’atmosphère en raison de sa grande volatilité et de sa faible capacité d'adsorption. Ses origines naturelles sont essentiellement l'eau de mer (il est fabriqué par certaines alguesalgues et bactériesbactéries) et la transformation des roches. La principale source anthropique est due aux stations de traitement des eaux, par action du chlorechlore sur la matièrematière organique dans les eaux de surfaces. De faibles quantités de chloroforme sont présentes dans l’eau du robinet (lorsqu'elle provient d'un réseau où le chlore est utilisé pour la désinfection), les aliments, l'airair extérieur et intérieur.
Le chloroforme est enregistré dans le registre des substances chimiques Reach, avec interdiction de commercialiser des mélanges à des concentrations égales ou supérieures à 0,1 % en poids. Les installations industrielles sont également tenues de respecter des seuils de rejet dans l'air et dans l'eau.
Les dangers du chloroforme
Il est irritant pour la peau et les yeuxyeux. L'inhalationinhalation des vapeurs (exposition de 3 minutes à des concentrations de 920 ppmppm) entraîne des vertiges et étourdissements. À forte dose, le chloroforme est toxique pour le cœur, le système nerveux centralsystème nerveux central et le foiefoie. Bien qu'il ne soit pas inflammable, le chloroforme peut se décomposer sous l'action de la chaleurchaleur en chlorure d'hydrogènechlorure d'hydrogène et en phosgène, des gazgaz corrosifs et toxiques. Il réagit violemment avec l'aluminiumaluminium, le magnésiummagnésium, les métauxmétaux alcalins, les bases fortes comme la soudesoude et la potasse ainsi que les alcoolates alcalins.
Histoire et utilisations du chloroforme
Pendant plus d'un siècle (de 1847 avec Pierre Flourens, à 1940), le chloroforme a été utilisé comme anesthésiantanesthésiant pour soulager la douleurdouleur et endormir les blessés. La reine Victoria y a eu recours lors de son accouchementaccouchement et il a abondamment servi lors de la guerre de Sécession aux États-Unis. Après cela, le chloroforme a essentiellement été employé pour la synthèse de chlorodifluorométhane, ou HCFCHCFC-22, comme fluide réfrigérant. Cette substance a été interdite en Europe en 2004 dans les appareils électroménagers, puis en 2015 pour tous les usages.
Les usages actuels du chloroforme :
- fabrication d'hydrocarbures chlorofluorés (TéflonTéflon par exemple) ;
- extraction d'huiles essentielles et d'alcaloïdesalcaloïdes ;
- extraction des antibiotiquesantibiotiques, hormoneshormones, nicotinenicotine, quininequinine, vitaminesvitamines... dans l'industrie des produits pharmaceutiques ;
- solvantsolvant et agent de purification dans l'industrie des matières plastiquesmatières plastiques.
























