Des chercheurs ont mis en évidence un nouveau type de liaison hydrogène qui présente une force similaire voire supérieure à certaines liaisons covalentes. Ces liaisons pourraient intervenir dans de nombreuses réactions chimiques et servir dans le domaine de la biologie ou les piles à combustible.
au sommaire
Il existe en chimie trois types de liaison : la liaison covalente, qui résulte de la mise en commun d'électrons entre deux atomes, la liaison ionique où les électrons d'un ion sont transférés à un atome voisin, et la liaison intermoléculaireliaison intermoléculaire ou Van der Waals (à laquelle appartiennent les liaisons hydrogène)), qui sont plus faibles par rapport aux deux précédentes. Ces trois liaisons sont toutes relativement stables. Mais les chercheurs savent depuis longtemps que lors d'une réaction chimiqueréaction chimique, il existe des états intermédiaires où les atomes peuvent se lier pendant quelques fractions de seconde et sont donc plus difficiles à observer.
Le saviez-vous ?
Les trois types de liaison chimique
1. Liaison covalente (liaison forte) : deux atomes mettent en commun les électrons de la couche électronique la plus extrême. Elle peut être polaire (lorsque l’attirance des électrons est inégale entre les deux atomes) ou non polaire (lorsque les deux atomes tirent avec une force semblable). Ces liaisons covalentes forment des molécules.
2. Liaison ionique (liaison forte) : des ions chargés positivement ou négativement s’attirent mutuellement en raison de leur différence de charge électrostatique. Par exemple, dans le sel de cuisine (NaCl), le sodium (chargé positivement) est attiré par le chlorure (chargé négativement).
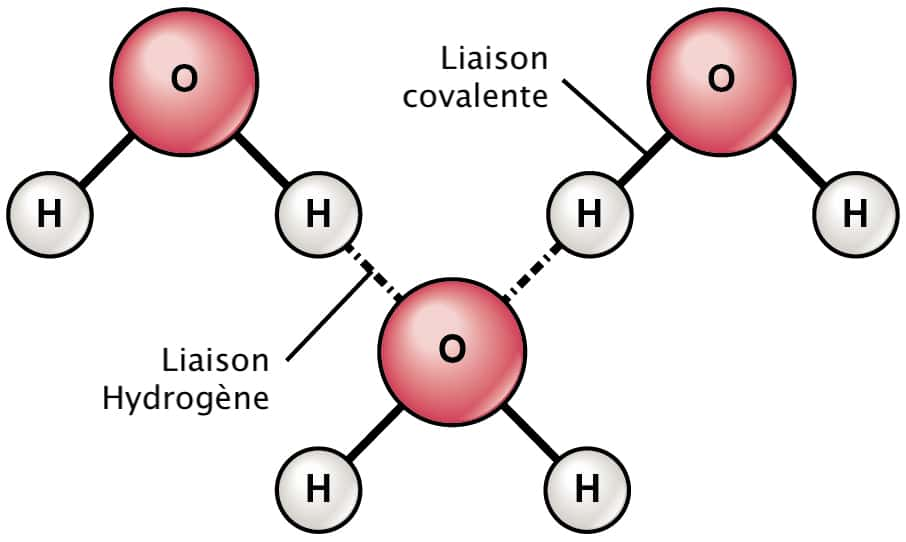
3. Liaison hydrogène (liaison faible) : un atome d’hydrogène portant une forte charge partielle positive est attiré par un autre atome très électronégatif. Elle se forme entre des molécules mais aussi entre différentes régions d’une même grosse molécule (par exemple une protéine).
Des liaisons hydrogène fortes
Une nouvelle étude parue dans la revue Science a réussi pour la première fois à observer un de ces états intermédiaires, mettant au jour un nouveau type de liaison chimiqueliaison chimique : une liaison hydrogèneliaison hydrogène mais avec la force d'une liaison covalenteliaison covalente (en principe, la liaison hydrogène est environ 20 fois plus faible). Pour ce faire, les chercheurs ont dissous un composé hydrogène-fluorure dans l'eau et ont regardé comment les atomes d'hydrogène et de fluorfluor interagissaient grâce à un appareil à spectroscopie enregistrant les vibrationsvibrations des atomes sous lumièrelumière infrarougeinfrarouge. Ils ont constaté que les atomes de fluor étaient attirés par les atomes d'hydrogène du fait d'un déséquilibre de charges positives et négatives, comme dans une liaison hydrogène standard. Dans la solution d'anionanion bifluorure, chaque atome d'hydrogène a ainsi tendance à être « pris en sandwich » entre deux atomes de fluor.
Mais les chercheurs ont constaté que ces sandwichs étaient liés ensemble avec plus de force que les liaisons hydrogène typiques. Dans ces courtes liaisons hydrogène, les atomes se rapprochent dans une structure ressemblant à une molécule, ce qui est caractéristique normalement d'une liaison covalente. Mais le mécanisme de la nouvelle liaison étant de nature électrostatiqueélectrostatique, cela signifie que la liaison reste bien de nature Van der Waals.
D'après les mesures des chercheurs, ces nouvelles liaisons ont une énergieénergie de liaison de 45,8 kcal/mol (environ 192 kJ/mol), ce qui est supérieur à certaines liaisons covalentes. Une moléculemolécule d'azoteazote est par exemple constituée de deux atomes reliés par une liaison de force 38 kcal/mol. Les liaisons hydrogène ont pour leur part une énergie de liaison de 1 à 5 kcal/mol. Cette découverte n'est pas entièrement une surprise, mais elle brouille les cartes des définitions des liaisons chimiques et des molécules. En effet, des atomes connectés par des liaisons covalentes sont considérés comme une molécule, tandis que des atomes connectés via une liaison hydrogène peuvent rester dans des molécules indépendantes.
Une possible liaison forte entre les molécules d’eau ?
Selon des chercheurs de l’Institut Max-Planck (non impliqués dans l'étude), il est possible que ce type de liaison existe dans l’eau, où un ion hydrogène est pris en sandwich entre deux molécules d'eau. Ces liens n'ont encore jamais été observés de manière concluante car leur duréedurée de vie serait beaucoup plus courte qu'avec le fluor. « L'étude de ces mouvementsmouvements moléculaires et comment ils peuvent être orientés dans une direction souhaitée pourrait trouver des applicationsapplications dans le transport des protonsprotons en biologie et dans les technologies telles que les membranes à pile à combustiblepile à combustible », indiquent les chercheurs.