au sommaire
Si, en France, les thermomètres à mercure ont été interdits en 1998, ce métal fait tout de même partie de notre quotidien. On en trouve dans certaines piles, dans les plombages (qui portent mal leur nom), ainsi que dans les lampes fluorescentes. Découvrez tout de l'utilisation du mercure.
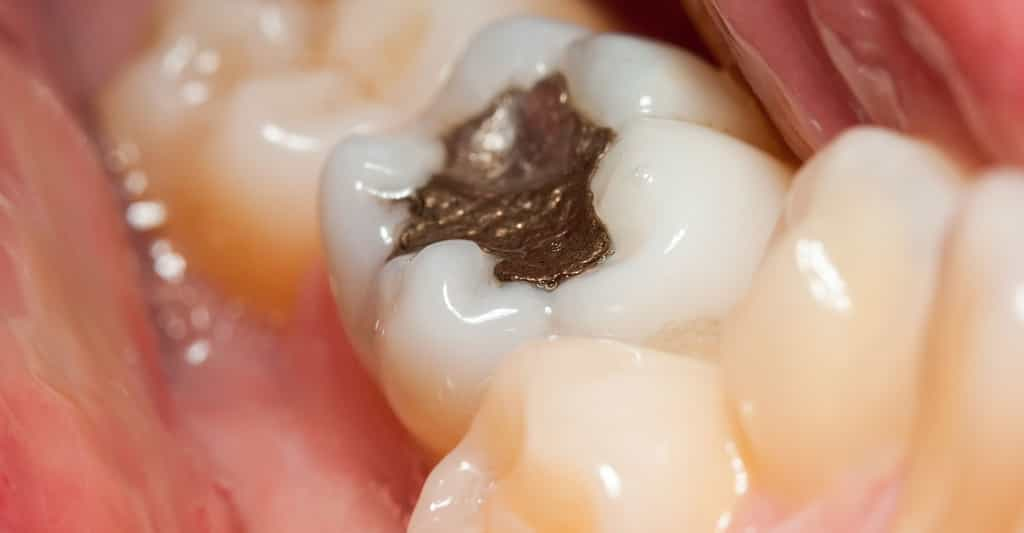
Amalgame dentaire à base de mercure. © Szasz-Fabian Jozsef, Shutterstock
Secteurs d'utilisation du mercure
Les principaux secteurs d'utilisation sont cités sur le schéma ci-dessous. Les chiffres sont pris sur la consommation américaine de 1994, qui est de 530 tonnes de mercure.
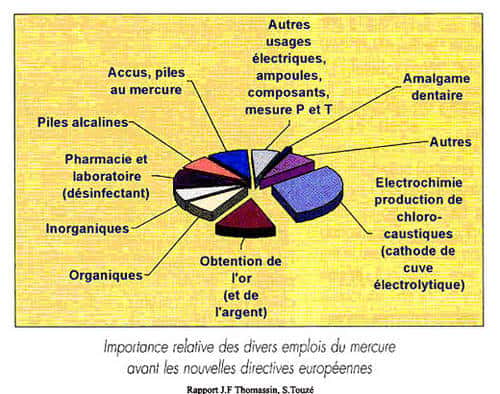
Les emplois du mercure dans la consommation américaine, en 1994. © DR
- NaOH - Cl 2 : 150 t, voir détails ci-dessous
- Interrupteurs : 87 t
- Appareils de mesure : 60 t
- Autres appareils électroniques : 55 t
- Catalyse : 28 t
- Amalgames dentaires : 26 t
- Applications de laboratoire : 26 t
- Lampes : 25 t
- Piles (953 t en 1985 !)) : 7 t
- Autres : 66 t
Utilisation du mercure en France
Situation française : en 1994, il n'y avait pas de mines ni de métallurgique de première fusion, les choses ont plutôt tendance à s'améliorer dans ce domaine ; la prise de conscience a eu lieu et des mesures ont été prises, même si elles ne sont pas toujours bien respectées.
- Importations françaises : 53 t/an
- Exportations françaises : 20 t/an
- Consommation française : 62 t/an.
Dans les lampes fluorescentes : en 1996, la France consommait 40 millions de lampes fluorescentes (15 mg Hg), 5 millions de lampes fluocompacteslampes fluocompactes (10 mg Hg), 3,6 millions de lampes luminescentes (30 mg Hg). Soit 1 t de Hg/an. Traitement des lampes fluorescentes : en France, le traitement est effectué par deux camions-usines de la société Provalor qui traite, à partir de 1998, 1 million de tubes.
Interdiction des thermomètres à mercure
Dans les thermomètres : cause d'une dispersion de 10 t de Hg/an, en 1998, la vente de thermomètres à mercure a été interdite en France.

Tubes fluorescents. © DR
Plombages et mercure
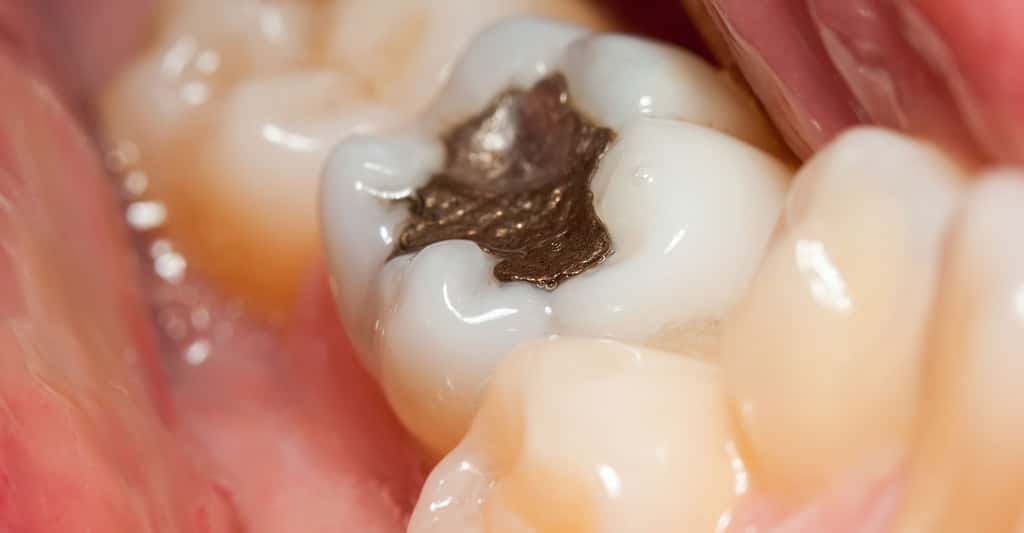
Dans les amalgames dentaires : ils contiennent 50 % de Hg (0,6 g de Hg par amalgame) et sont obtenus par trituration à froid d'une poudre métallique avec le mercure. Ils ne contiennent pas de plombplomb, malgré l'appellation de plombage.
En France, la consommation de 35 t de Hg/an pour les amalgames permet d'estimer que les dentistes rejetteraient 20 t/an de Hg soit les 3/4 de la pollution des particuliers ! Les vapeurs de Hg provenant des amalgames dentaires sont aussi rejetés dans l'atmosphèreatmosphère par les crémations. Le stock dans la bouche des Français est estimé à une centaine de tonnes.
L'amalgame dentaire (Hg-Ag-Sn) est une invention chinoise ancienne. II a fait ses preuves : sa duretédureté, sa résistancerésistance ses vertus bactéricides sont incontestables. On ignore tout de la longévité, de la cytotoxicité, etc. des substituts proposés actuellement.
Les quantités de mercure libéré dans l'organisme humain, essentiellement par ingestioningestion, sont très faibles et le mercure ingéré est peu sensible à la méthylationméthylation par les bactériesbactéries intestinales.
Dans certains cas, l'amalgame peut entraîner des réactions allergiques ou provoquer de l'électrogalvanisme. Le matériau compositematériau composite ne peut pas, pour le moment, être considéré comme un substitut parfait à l'amalgame.
Amalgame dentaire. © DR
En France, la Société Duclos Environnement recycle le mercure des déchetsdéchets industriels et domestiques (thermomètres, amalgames dentaires...). Les déchets sont traités dans un four sous vide (0,01 barbar) entre 350 et 700 °C. Le mercure y est distillé et récupéré par condensationcondensation.
Piles et mercure
Les piles : la consommation française est de 600 millions de piles/an, soit 22 000 tonnes de mercure :
- Les piles salines : elles contenaient 0,6 % de Hg amalgamé avec le zinczinc et permettait ainsi d'éviter l'oxydationoxydation du zinc par l'eau, ce qui représentait 10 à 20 t de mercure rejeté. Actuellement les piles salines ne contiennent plus de mercure.
- les piles alcalinesalcalines : la teneur en Hg est de 0,025 %.
- les piles boutonpiles bouton : 10 % de ces piles ont une cathodecathode constituée d'un mélange HgO-C (appareils auditifs). Elles contiennent 30 % de Hg. En France, la consommation est de 40 t/an de piles bouton.

Accus. © DR
Traitement des piles : le décret du 12 mai 1999 n° 99-374 interdit le rejet en décharge et incite au recyclagerecyclage des piles et accumulateurs. Les piles et accumulateurs triés suivent les filières de recyclage reconnues.
La France utilise chaque année environ 720 millions de piles et accumulateurs, soit environ 12 unités par habitant. On estime à 70 % le pourcentage de ces piles qui finissent dans la nature, à la décharge ou sont incinérées avec les ordures ménagères. La France dispose pourtant de sites de traitement (six sites pour le traitement des piles, un site pour les accumulateurs au nickelnickel-cadmiumcadmium et quatre pour les accumulateurs au plomb) d'une capacité théorique supérieure à la totalité des quantités mises sur le marché.
Les différentes techniques utilisées pour le recyclage sont hydrométallurgique (Eurodieuze, Récupile), pyrométallurgique (Citron, Valdi) ou thermique (Duclos environnement, MBM).
À côté de la problématique environnementale, le retraitement des piles n'est pas à négliger : ce sont près de 4.500 tonnes de zinc, 5.500 tonnes de manganèsemanganèse, 10 à 12 tonnes de mercure environ qui pourraient être réutilisées ! Un véritable gisementgisement de matériaux parfois coûteux et non renouvelables.
Les télescopes à miroir liquide et le mercure
Le plus puissant télescopetélescope du Canada, construit en banlieue de Vancouver, est un télescope à miroirmiroir liquideliquide de 6 m de diamètre - le Large Zenith Telescope.
Il pourrait bouleverser le monde de l'astronomie car il emploie une technologie révolutionnaire beaucoup moins coûteuse que celle des télescopes conventionnels. Au lieu d'utiliser du verre poli pour réfléchir la lumièrelumière, le télescope de Vancouver utilise en effet un bassin de mercure en rotation qui épouse la forme d'une parabole parfaite.
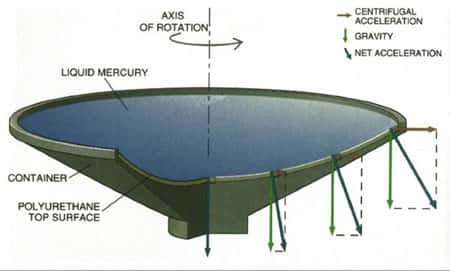
Télescope à miroir liquide. © DR
On utilise une mince couche de mercure en rotation. Grâce à la force centrifugeforce centrifuge, le mercure prend la forme d'une parabole parfaite, la forme requise pour capter la faible lumière des étoilesétoiles. En éliminant l'étape, très onéreuse, du polissage du verre, le miroir au mercure peut coûter jusqu'à 20 fois moins cher.
Ce concept magique ne date pas d'hier ; l'astronomeastronome italien Ernesto Capocci a lancé l'idée dès 1850. Au début des années 90, Paul Hickson a bricolé un modèle de trois mètres dans sa cour. Ce modèle a attiré l'attention la NasaNasa. « On a commencé la constructionconstruction en 1990, puis, en 1994, on a capté nos premières images à l'aide de ce télescope exceptionnel. C'était le 17e plus grand télescope au monde, et il a fonctionné à merveille pour détecter les débris spatiaux », soutient Mark Mulroney, astronome pour la Nasa.
Paul Hickson compte bien gagner... mais le mercure, présente toutefois plusieurs désavantages. Sa densité élevée entraîne des coûts élevés liés au transport et à la puissance du moteur du dispositif rotatif, mais surtout sa viscositéviscosité peu élevée entraîne des déformations à la surface lors de l'inclinaison du miroir, limitant ainsi l'observation au zénithzénith.
La chimiechimie des colloïdescolloïdes apporte donc une alternative intéressante au mercure : les films métalliques liquiformes, ou MELLFs (pour Metal Liquid Like Films). Les MELLFs sont des suspensions colloïdales métalliques très concentrées, dont l'aspect et les propriétés mécaniques les rendent très semblables à un métal sous phase liquide.... à venir et à suivre !
L'ILMT, le télescope dont va se doter l'université de Liège possédera un miroir liquide de 4 mètres de diamètre pour une distance focaledistance focale de 8 mètres. Cette dernière est déterminée par la courbure du miroir, car plus un miroir est incurvé (en rotation rapide), plus la focale est courte. L'incurvation du miroir dépend d'un seul paramètre : la vitesse de rotationvitesse de rotation qui lui est imprimée, laquelle fixe la force centrifuge imposée au mercure.
Le télescope à miroir liquide devrait avoir un rôle primordial à jouer dans l'étude des mirages gravitationnels, étude qui contient des éléments susceptibles d'orienter plusieurs grands débats scientifiques actuels.
Afin de mettre tous les atouts de leur côté, les astrophysiciensastrophysiciens de l'université de Liège se proposent de travailler dans la lumière rouge. À cela, deux raisons principales :
- D'une part, lors de la pleine lunepleine lune, la clarté du ciel est telle qu'il s'avère impossible de mener à bien des observations dans le bleu.
- D'autre part, le rouge est moins facilement « éteint » par la poussière. Or, il se pourrait que les lentilles gravitationnelleslentilles gravitationnelles en renferment de grandes quantités, ce qui aurait pour effet de diminuer le nombre apparent de mirages gravitationnels observés.
Le télescope à miroir liquide a donc de beaux jours devant lui.
Utilisation du mercure pour extraire l'or et l'argent
Le procédé d'amalgamation n'est utilisé que dans des installations artisanales, ce qui le rend d'autant plus dangereux (Amazonie), et concerne largement plus que 10 % de la production mondiale d'or.
Voir notre dossier L'or la magie des alchimistes.
Il est estimé que, entre 1580 et 1990, la quantité totale de mercure rejeté dans l'environnement, sur le continent américain, lors du traitement des métauxmétaux précieux, a été, en gros, de 260.000 tonnes. Il était utilisé de 6 à 8 kgkg de Hg/kg de Ag, et pour chaque kg de Ag extrait, par exemple à Potosi, 1,5 kg de Hg était rejeté dans l'environnement.
Dans les installations modernes de traitement des mineraisminerais d'or et d'argent, le mercure contenu dans le minerai est récupéré, du moins en principe, mais dans les installations sauvages d'Amazonie le problème est très grave.
Production de mercure
Production : le maximum de la production mondiale de mercure métal a été atteint en 1970 avec 10.000 tonnes.
Pour la première fusion, la production mondiale en 1994 est de 1985 tonnes, les cinq plus gros producteurs étant :
- la Chine : 610 t en 2003, nouveau venu mais pas des moindres.... On considère aussi que la Chine consomme 50 % de la production mondiale de mercure : batteries mercure-zinc, production de soude caustique, dentisteriedentisterie, commutateurscommutateurs électroniques, tubes fluorescentstubes fluorescents, amalgamation sur les mines d'or.
- le Kirghizistan : 510 tonnes
- l'Algérie : 449 tonnes
- l'Union européenne : 393 tonnes, les exportations espagnoles ont été de 1.800 tonnes, à 87 % vers Hong Kong.
De nombreux gisements d'or épithermaux ont du mercure dans leurs minerais, lequel est aujourd'hui récupéré lors de la première fusion de l'or en doré. De nombreuses fonderies de zinc récupèrent le mercure que contient la sphalérite de certaines mines de métaux de base.
Conditionnement : en potiches de 34,5 kg net.
Métallurgie
La récupération du mercure peut avoir lieu lors de diverses métallurgies :
- Métallurgie de l'or et de l'argent : lors du traitement du minerai par cyanuration, le mercure se comporte comme l'or et l'argent et se retrouve, après électrolyseélectrolyse, avec ces éléments, sur la cathode. Avant fusion de la cathode et obtention du « doré », le mercure est éliminé et récupéré par distillationdistillation puis condensé dans des retortes maintenues sous vide. Par exemple, aux Etats-Unis, 75 t de Hg/an sont ainsi récupérées.
- Métallurgie du zinc : lors du grillage de la blendeblende, le mercure, principalement sous forme métallique, se retrouve à l'état de vapeur avec le dioxyde de soufresoufre. Afin d'éliminer le mercure, le procédé Norzink est le plus employé et consiste à fixer le mercure dans une solution de chlorure mercurique selon la réaction :

Unité de grillage de blende. © DR
Une partie du chlorure mercureux est oxydé par le dichlore afin de régénérer, en solution, le chlorure mercurique, selon la réaction :
Après traitement, le gazgaz contient moins de 0,05 mg de Hg/m3. Le mercure peut être récupéré par électrolyse de la solution de chlorure mercurique.
Le mercure ainsi récupéré représente 360 t/an dans le monde.
Cellules à cathode de mercure pour la production de chlore et de soude
Le chlorechlore et la soude sont deux produits extrêmement importants dans l'industrie ; ils sont obtenus à partir du sel par électrolyse dans des cellules d'électrolyse dont les cathodes contiennent du mercure à raison de 3 à 4 t de Hg par cellule et l'amalgame formé contient 0,5 % de Na. Les rejets de Hg dans l'air sont inférieurs à 2 g/t de chlore.
Voir notre dossier La route du sel, histoire, géologie, alimentation
Dans l'industrie électrochimique, la chimie du chlore constitue encore toujours la branche la plus importante : annuellement plus de 50 millions de tonnes de chlore.
Le dichlore est utilisé lors :
- de la synthèse du PVCPVC, une matièrematière synthétique importante,
- de la préparation d'hydrocarbureshydrocarbures chlorés : solvantssolvants, réfrigérants liquides, insecticidesinsecticides, pesticidespesticides, fongicidesfongicides, etc.
Lors de la production on peut préparer l'hydroxyde de sodiumhydroxyde de sodium et l'hydrogènehydrogène.
La matière première utilisée est de la saumuresaumure, solution saturée de NaCl.
Lors de l'électrolyse d'une solution aqueusesolution aqueuse de NaCl, les demi-réactions ci-après constituent un point de départpoint de départ intéressant :
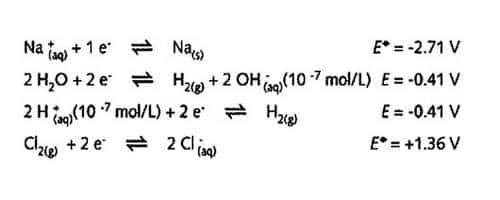
Réactions électrolyse. © DR
Les trois procédés de fabrication électrolytique que l'on utilise le plus fréquemment dans la pratique, soit 95 % de la production, fournissent tous, en plus du dichlore, également du gaz d'hydrogène et de l'hydroxyde de sodium. Néanmoins, ils diffèrent par la manière utilisée pour empêcher le contact entre le chlore et NaOH.
Procédé avec cathode de mercure (cellule de Castner-Kellner, 1892)
Les lames d'anodeanode ont été réalisées de tout temps en graphitegraphite. Actuellement, on les remplace de plus en plus par des aciersaciers au Ti ou au Pt qui sont plus coûteux mais possèdent une duréedurée de vie plus longue. Le chlore gazeux que l'on obtient, dont la solubilité dans l'eau n'est pas illimitée, sera capté dans la partie supérieure de la cellule électrolytique. Le métal Na(s) se dépose sur la cathode.
La spécificité de ce procédé réside dans la composition de la cathode : du mercure. Par le fait que le métal Na obtenu est à même de former de manière relativement immédiate un amalgame avec Hg, il est extrait de la phase aqueuse.
L'amalgame de sodium évacué, NaHg, doit être maintenu en contact avec H2O. En effet, l'hydrolysehydrolyse de NaHg, une réaction redox normale, fournit de l'hydrogène gazeux et une solution d'hydroxyde de sodium. Elle régénère également le Hg qui peut à nouveau être pompé (recyclé) dans la cathode de mercure. Des billes de graphite font office de catalyseurcatalyseur pour cette réaction de décomposition par ailleurs auto-entretenue.
Ce procédé en continu exige également une évacuation constante de la saumure appauvrie et son remplacement par un mélange qui possède une plus grande quantité de NaCl.

Ligne de production. © DR
Dans une ligne de production, on relie l'une à l'autre approximativement 200 cellules au mercure. Les dimensions de chaque cellule individuelle s'élèvent à 15 m x 2 m x 0,3 m. Une production électrolytique de ce type nécessite une quantité d'électricité gigantesque correspondant à 3 MWh par tonne de chlore ! Ceci est dû, entre autres, à la tension élevée à laquelle se déroule cette électrolyse.
Procédé avec cellule à diaphragme (cellule de Griesheim, 1885)
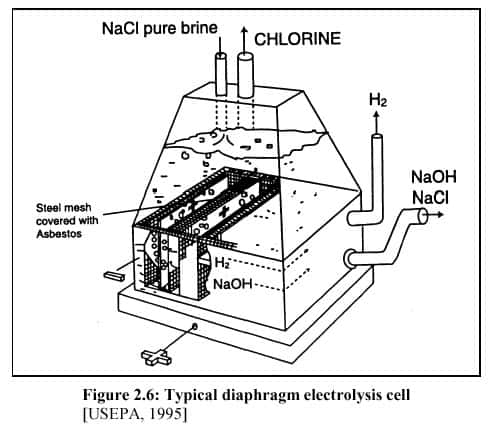
Cellule à diaphragme. © DR
La saumure traverse un diaphragmediaphragme qui est réalisé en amianteamiante et qui est fixé sur une grille en acier qui fait office de cathode. Le diaphragme en amiante possède une durée de vie d'environ deux mois. Son remplacement régulier présente une pollution importante pour le milieu.
Procédé avec cellule à membrane (1970)
La cellule à membrane ressemble à la cellule à diaphragme. La séparationséparation entre le compartiment anodique et le compartiment cathodique est constituée par une membrane constituée d'un polymèrepolymère spécifique qui laisse passer des cationscations (Na+) de manière sélective.
Dans les deux cas b et c, on évite autant que possible, précisément par le diaphragme ou par la membrane, le contact entre le Cl2 gazeux et la solution de NaOH. Remarquons également que la tension électrique à laquelle ces électrolyses ont été réalisées, est considérablement inférieure à la tension requise dans le procédé faisant appel à une cellule au mercure.
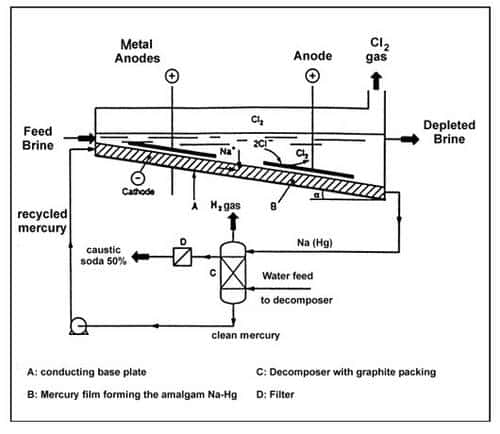
Cellule à mercure. © DR
En Europe occidentale, il y a prédominance de l'électrolyse à mercure (en juin 2000) : 55 %, les 45 % restants sont obtenus par l'électrolyse à diaphragme (22 %), l'électrolyse à membrane (20 %) et d'autres procédés (3 %).
Aux États-Unis, prédominance de l'électrolyse à diaphragme : 75 %
Au Japon, prédominance de l'électrolyse à membrane : > 90 %
65 % de la capacité mondiale de production de chlore et de soude caustique sont concentrés dans trois régions : l'Amérique du Nord, l'Europe occidentale et le Japon ; la production de l'Europe occidentale semble aujourd'hui stabilisée aux alentours de 9 millions de tonnes par an.
La pollution la plus préoccupante générée par l'industrie du chlore et de la soude est la pollution par le mercure. En 1998, le volumevolume total des émissionsémissions de mercure dans l'air, l'eau et les produits provenant des usines de chlore d'Europe occidentale était de 9,5 tonnes. Toutefois, ce sont les divers déchets du procédé qui sont à l'origine de l'essentiel des pertes de mercure. Usine par usine, la teneur en mercure des rejets solidessolides était comprise entre 0 et 84 g Hg/tonne de capacité de production de chlore en 1998, selon Euro Chlor.
À l'heure actuelle, quelque 12.000 tonnes de mercure sont contenues dans les cellules d'électrolyse servant à la production de chlore dans l'Union européenne. Lors de la conversion ou de la mise à l'arrêt des installations, ce mercure est susceptible d'être libéré dans l'environnement. Pour le moment, il n'existe pas de politique ou de législation au niveau de l'Union européenne qui réglemente la gestion de cette énorme quantité de mercure pur.
Le principal problème posé par la technique de l'électrolyse à diaphragme est celui de l'amiante. Tant l'exposition potentielle des travailleurs à l'amiante que les rejets d'amiante dans l'environnement sont préoccupants.
La technique de l'électrolyse à membrane présente des avantages écologiques intrinsèques par rapport aux deux procédés plus anciens, puisqu'elle n'utilise ni mercure ni amiante et qu'elle a le meilleur rendement énergétique. En dépit de ces avantages, la technique a été lente à démarrer en Europe, parce que la plupart des usines existantes de chlore ont été installées dans les années 70 pour une durée de vie de 40 à 60 ans, et qu'il n'y a pas eu besoin d'une nouvelle capacité de production. Il n'y a pas eu non plus de pressionpression de la part des législateurs pour susciter un changement de technique.