au sommaire
Découvrez ici les propriétés physiques et chimiques du mercure, ce métal si surprenant qui a la particularité d'être liquide sous les conditions normales de température et de pression.

Le cinabre est une espèce minérale composée de sulfure de mercure. Il se distingue du vermillon qui est un pigment minéral artificiel produit par synthèse. © S_E, Shutterstock
Le mercure, de symbole Hg
Le symbole du mercure est Hg. La teneur moyenne de l'écorce terrestre en mercure est de 0,05 ppm.
Les mineraisminerais exploités contiennent de 0,5 à 5 % de Hg.

Cinabre. © Dave Barthelemy, tous droits réservés
On en exploite 10.000 tonnes par an, dont seulement 20 % sont recyclés, ce qui laisse une bonne dose de mercure disponible pour la pollution...

Du métacinabre, une espèce minérale de sulfure de mercure avec des traces de zinc, sélénium, cadmium et fer servant de minerai de mercure. © Lou Perfoff Webmineral, tous droits réservés
On trouve du mercure associé avec le réalgar (AsS) et l'orpiment (As2S3)). Certaines roches peuvent se minéraliser en cinabre, c'est le cas de ce quartzitequartzite ! La couleurcouleur rouge est « prise » dans la roche elle-même.

Quartzite minéralisé en cinabre. © Webmineral, tous droits réservés
Propriétés physiques du mercure
- Masse volumiqueMasse volumique : 13.579,04 kgkg/m3 pour le mercure liquide à 25 °C mais 14,6 pour le mercure solidesolide à 5 K et 14,2 à -39 °C ce qui implique une très brutale chute de densité au moment de la fusionfusion à -38,8 °C
- Structure cristalline : l'état cristallin a été étudié entre 5 et 206 K à P atm (atmosphèreatmosphère normale) ; le mercure est rhomboèdrique et un atomeatome est entouré de 6 autres à une distance de 3 Å, ce qui correspond au double du rayon covalent de 1,48 Å.
- Couleur : argenté blanc
- Masse atomique : 200,59 u
- Configuration électroniqueConfiguration électronique : Xe 4f14 5d10 6s2
- États d'oxydationoxydation (oxyde) : 2, 1
- Température de fusion : 234,32 K
- Température de vaporisationvaporisation : 629,88 K
- Point triplePoint triple : -38,8344 °C, point fixe de l'échelle internationale des températures (ITS-90)
- Électronégativité (Pauling) : 2,00
- ChaleurChaleur massique : 138,8 J/(kg.K)
- ConductivitéConductivité électrique : 1,04×106 S/m
- Conductivité thermiqueConductivité thermique : 8,34 W/(m.K)
- ViscositéViscosité : 17,0×10-3 Pl. La viscosité dynamique μ (ou encore η) se mesure en pascal-seconde (Pa.s), cette unité ayant remplacé le poiseuille (Pl) qui a la même valeur.
- Tension superficielle : 480 mN/m à 20 °C
- Pression de vapeur : à 20 °C on a 0.26 Pa
- Densité de vapeur relative (airair = 1) : 6.93
- Densité relative du mélange air-vapeur à 20 °C (air = 1) : 1.009

On voit ici l'évaporation du mercure sous cloche (en bas à droite de l'image). Les plumets présents dans l'alcôve sont destinés à recueillir le mercure liquide. © DR
Les vapeurs de mercure sont nocives. On notera que le mercure est le seul élément en dehors des gazgaz rares à exister sous forme de vapeur monoatomique. La pression de vapeur saturante P* du mercure est donnée en kilopascals par les formules suivantes :
- log P* = 7,149 - 3212,5/TT entre 273 et 423 K
- log P* = 7,003 - 0,000197(T-273) - 3141.33/T entre 423 et 673 K
Ces données sont importantes, compte tenu de la nocivité des vapeurs de ce métal.
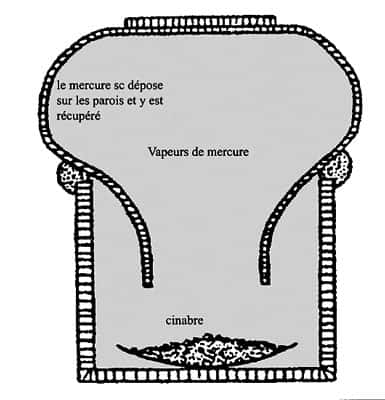
Appareil à sublimer. © DR
Limites d'exposition professionnelle (LEP)
D'après les fiches de sécurité chimique internationales, les Limites d'exposition professionnelle (LEPLEP) sont :
TLV : 0.025 mg/m³ TWA ; (peau) ; A4 ; BEI publié ; (ACGIH 2004).
MAK: 0.1 mg/m³ ; Sh ; Classe de limitation des taux les plus élevés : II(8) ;
Catégorie de carcinogénicité : 3B ; (DFG 2003).
Isotopes du mercure
Selon Debeler, voici les isotopesisotopes du mercure :
- 189 : période 30 mn
- 190 : période 90 mn
- 191 : période 57 mn
- 192 : période 6 h
- 193 : période 6 h
- 194 : plus ou moins stable
- 195 : période 9,5 h
- 196 : 0,156 % stable
- 197 : période 66 h
- 198 : 10,12 % stable
- 199 : 16,99 % stable avec un isomèreisomère métastablemétastable
- 200 : 23,07 % stable
- 201 : 13,27 % stable
- 202 : 29,64 % stable
- 203 : période de 46-47 jours
- 204 : 6,79 % stable
- 205 : période 5,5 mn
On sait aujourd'hui que le mercure peut donner... de l'or. En effet, l'isotope 197 de Hg se transforme en isotope 197 de l'or, stable, en passant par un état métastable.
Le mercure, un métal liquide
Sous les conditions normales de température et de pression, le mercure est le seul métal à l'état liquideétat liquide. Pourquoi ?
Cette propriété physique résulte de sa température de fusion de - 39 °C, donc il est solide pendant l'hiverhiver sibérien ! Les éléments voisins dans le tableau périodiquetableau périodique sont tous solides, mais ductilesductiles et malléables... et ils ont des températures de fusion relativement basses, par exemple le cadmiumcadmium est mou et fond à 321 °C, le zinczinc est tendre et fond à 420 °C.
L'atome possède 80 électronsélectrons dont 2 situés sur la couche électroniquecouche électronique externe ; ces deux électrons, bien qu'occupant la sixième couche, sont très liés au noyau atomique, de sorte qu'ils ne sont pas partagés avec ceux de la couche correspondante d'un atome voisin : la liaison atome-atome est très faible et facilement rompue par un petit apport de chaleur. Pour la même raison, le mercure est un mauvais conducteur thermique et électrique.
Mercure et alliages : les amalgames
Le mercure forme des alliagesalliages avec presque tous les métauxmétaux communs, à l'exception du ferfer, du nickelnickel et du cobaltcobalt et il est difficile avec le cuivrecuivre, le platineplatine et l'antimoineantimoine. Ces alliages sont appelés « amalgamesamalgames ».
Propriétés chimiques du mercure
Solubilité dans l'eau : 0,02 à 0,03 mg/L à 20 °C, soit environ 10-7 at-g/L et 0,06 à 100 °C, le tout à l'abri de l'air. Un équilibre s'établit entre le mercure dissous, le mercure liquide non dissous et la vapeur de mercure.
Potentiel redox :
Hg22+ + 2e → 2 Hg° avec E° = 0,79
2 Hg 2+ + 2e → Hg22+ avec E° = 0,92
Ne réagissent pas avec le mercure dans les conditions normales :
- l'hydrogènehydrogène,
- les gaz rares,
- l'oxygèneoxygène ou l'air très secs,
- l'eau,
- HF,
- HCl,
- HI, HBr et NH3 s'ils sont secs.
En revanche, les halogèneshalogènes se combinent tous directement au mercure et l'ozoneozone réagit très rapidement, de même que l'oxygène si l'atmosphère est humide, s'il y a des UVUV ou si la température est élevée.
Le soufresoufre, le selenium et le telluretellure se combinent facilement avec le mercure ainsi que de nombreux métaux. NH3 réagit très fortement si l'atmosphère est humide à pression ordinaire et donne un composé rouge brun explosif dans lequel l'oxygène est fourni par l'eau : (Hg2N) O (NH3) x
Les acidesacides réagissent, par exemple HCL dilué en présence d'oxygène :
2Hg + 2 HCl + H2O2 → Hg2Cl2 + 2H2O
L'acide sulfuriqueacide sulfurique réagit de même que l'acide nitrique mais pas l'acide phosphorique. L'eau régaleeau régale attaque aussi le mercure : du mercure HgCl2 est alors produit.
Le mercure tend à former des liaisons covalentesliaisons covalentes avec les composés soufrés. Les thiols étaient autrefois nommés « mercaptans », du latin mercurius captans.
Les solutions salines sont nombreuses à réagir avec le mercure : iodure de K de Zn donnent du iodure mercurique rouge, le persulfate de Na, le chlorure ferrique, le chlorure cuivrique, etc.
Mais les sels de mercure réagissent aussi facilement avec l'ammoniacammoniac en présence d'ammonium et on obtient des ammines (attention : Ici « ammine » a 2 m parce qu'il s'agit de composés inorganiques par coordination entre l'ammoniac et un sel métallique), par exemple :
- des diammines du type Hg(NH3)2Xn, où X= NONO3, SCNSCN, SO3, S2O3
- ou des tétrammines du type Hg(NH3)4Xn, où X= NO3, SCN, SO3, S2O8, ClO4.
Les propriétés remarquables du mercure l'ont rendu utile dans une foule de domaines :
- baromètresbaromètres,
- manomètresmanomètres,
- thermomètresthermomètres,
- densitomètres,
- pompes à diffusiondiffusion de vapeur sous vide poussé (lampes radio),
- joints de canalisationcanalisation sous vide,
- gyroscopesgyroscopes,
- tubes luminescents,
- redresseurs de courant,
- interrupteurs,
- miroirsmiroirs,
- amalgames,
- pharmacie,
- fongicidesfongicides,
- catalysecatalyse,
- électrodesélectrodes.
Mais certaines de ces utilisations sont tombées en désuétude à cause de la toxicitétoxicité et la difficulté d'emploi du mercure.
Découvrez à présent quelques composés du mercure intéressants : le calomel, le chlorure mercurique HgCl2, les oxychlorures, les organomercuriels et la base de Millon.
Le calomel
Le chlorure mercureux Hg2Cl 2 : le calomel.
Le chlorure mercureux se forme par action directe du chlorechlore sur le mercure par voie sèchevoie sèche ou humide. Par voie sèche par exemple :
Lavé à l'eau tiède, essoré, séché à 100 °C à l'abri de la lumièrelumière, on le purifie par l'étheréther qui dissout seulement le chlorure mercurique formé. Ce fameux calomel forme les électrodes de référence en électrochimie.
Une électrode à calomel est constituée d'une électrode de mercure en contact avec du calomel lui-même mélangé intimement à du mercure pour lui éviter la formation de chlorure mercurique, et baignant dans un électrolyte, habituellement du KCl. On a ainsi la chaîne Hg / Hg2Cl2 / KCl.
L'avantage de cette électrode est qu'elle reste identique à elle-même quel que soit le sens du courant !
En effet si elle sert d'anodeanode :
Cl2 + 2 Hg → Hg2Cl2
de cathodecathode :
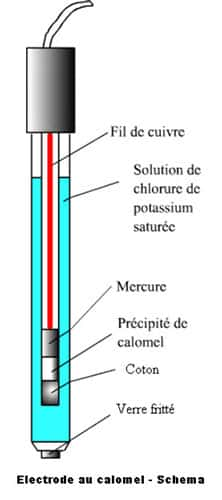
Schéma d'une électrode au calomel. © DR
Mais l'emploi de cette électrode n'est pas recommandé si la température est élevée.
Le chlorure mercurique HgCl2
Le chlorure mercurique HgCl2 est soluble dans de nombreux solvantssolvants organiques. Il est aussi soluble dans l'eau légèrement acide avec des ionsions Cl-, c'est-à-dire pratiquement toutes les eaux potables ! Et on obtient des ions chloromercurates (HgCl3)- ou (HgCl)4 2-.
Les oxychlorures
Les oxychlorures sont :
- HgCl2.3HgO, principal constituant de la kleinite hexagonale et de la mosesite cubique
- HgCl2.2HgO, ou Hg(OHgCl)2 (autre formule du même composé), peut être rouge s'il est hexagonal et noir s'il est monoclinique.
Ces oxychlorures existent donc à l'état naturel, de même que HgCl2.4HgO ou Hg4Cl4Hg6O8, dont les formes et les couleurs sont très diverses.
Les organomercuriels
Avec les amines ou d'autres composés azotés on peut obtenir très facilement des combinaisons analogues à celles obtenues avec NH3 qui ont un atome d'azoteazote lié au mercure par exemple avec :
- l'hydroylamine : Hg (NH2OH)2 Cl-
- la pyridine : Hg (C5H5N)2 Cl-
de même avec la quinoléine, l'urée, la méthionineméthionine ou l'histaminehistamine...
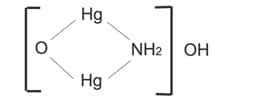
La base de Millon
Le mercure peut former une base en réagissant avec une solution ammoniacale dans certaines conditions et on obtient le composé suivant :