Si la reprogrammation cellulaire, avec les cellules souches pluripotentes, ouvre la voie vers de nouveaux médicaments et de nouvelles thérapies, le rajeunissement cellulaire permettra-t-il une revitalisation du corps entier ? Actuellement, où en est la médecine régénérative ? Peut-on espérer mieux soigner ou rêver, comme Jeff Bezos, de rajeunissement, voire d'immortalité ?
au sommaire
![]() Le rajeunissement par le biais de la reprogrammation cellulaire a fait récemment fantasmer des milliardaires comme Jeff BezosJeff Bezos, l'ex-P.-D.G. d'AmazonAmazon, ou le magnat russe Iouri Milner, probablement en quête d'immortalité.
Le rajeunissement par le biais de la reprogrammation cellulaire a fait récemment fantasmer des milliardaires comme Jeff BezosJeff Bezos, l'ex-P.-D.G. d'AmazonAmazon, ou le magnat russe Iouri Milner, probablement en quête d'immortalité.
Trois milliards de dollars ont ainsi été levés par la société de biotechnologiebiotechnologie Altos Labs, fondée par Milner et lancée officiellement le 19 janvier 2022, attirant les plus éminents scientifiques dont Shinya Yamanaka le Japonais, découvreur de la reprogrammation cellulaire, mais également Juan Carlo Izpisua Belmonte du Salk Institute for Biological Studies à La Jolla. Le but officiel est « de transformer la médecine au moyen de la programmation du rajeunissement cellulaire ». Bezos, lui, a largement investi dans la compagnie.
Fort de l'expertise de ces scientifiques de haut niveau, la biotech Altos Labs voudrait étendre le rajeunissement cellulaire à la revitalisation du corps entier, afin de prolonger la vie humaine.
Que se cache-t-il derrière cette technique ? Où en est-on vraiment ?
Quelles retombées pour la santé humaine ?
Les cellules humaines ont une duréedurée de vie programmée et leur caractéristique principale est de se diviser de façon contrôlée pour assurer la pérennité de nos tissus et organes. Une cellule vieillissante ou en état de sénescence, est une cellule qui ne se divise plus et qui sera éliminée par apoptose (mort cellulaire).
Ainsi va la vie...

Mais, en 2006, les travaux du prix Nobel de médecine 2012, le chercheur japonais Shinya Yamanaka, ont ouvert des champs de recherche jusque-là impensables, basés sur la possibilité de faire rajeunir nos cellules. L'introduction de quatre gènes spécifiques dans le génome de n'importe quelle cellule adulte (cellules de la peau ou cellules du sang par exemple) la fait rajeunir à un stade embryonnaire qu'on appelle cellule souche pluripotente induitecellule souche pluripotente induite et que l'on nommera cellule souche induite pour plus de simplicité.
La cellule souche ainsi induite retrouve les propriétés pluripotentes des cellules souches embryonnairescellules souches embryonnaires, c'est-à-dire qu'elle peut se différencier en n'importe quel type de cellule adulte, par exemple un neuroneneurone, une cellule cardiaque ou une cellule épithéliale. Ceci permet de penser que, dans le futur, il sera possible de réparer ou de fabriquer tout type d'organes ou de tissus à partir de ces cellules souches induites.
“Dans le futur, il sera possible de réparer ou de fabriquer tout type d’organes ou de tissus à partir de ces cellules souches induites”
Les premiers essais de réparation tissulaire à partir de cellules épithéliales de la rétinerétine provenant de la différenciation de cellules souches induites, ont été réalisés avec succès au Japon pour soigner la dégénérescence maculaire liée à l'âge.
Pionnier dans le domaine, le Japon a constitué une banque de cellules souches induites caractérisées immunologiquement qui correspondent à chaque type immunologique d'un receveur potentiel afin d'éviter les rejets de ce traitement cellulaire. Dans ces premiers essais de médecine régénérativemédecine régénérative, des cellules épithéliales saines ont été obtenues par différenciation de cellules souches induites humaines présentant une compatibilitécompatibilité immunologique optimale avec le patient receveur. Malgré ces premiers essais prometteurs, nous ne sommes qu'à l'aubeaube de l'utilisation des cellules souches induites en médecine régénératrice pour traiter des tissus plus complexes que l'œilœil tel que le cœur, le cerveau ou le pancréaspancréas.
En effet, le rajeunissement de la cellule adulte implique la réintroduction de gènes appelés facteurs de transcriptiontranscription qui, lorsqu'ils sont actifs, vont moduler l'expression d'autres gènes caractéristiques des cellules souches normalement inactivés dans la cellule adulte. Parmi ces facteurs de transcription, certains sont dit oncogéniques, c'est-à-dire qu'ils peuvent induire un cancercancer.
De même, il n'est pas sans risque d'utiliser des cellules adultes provenant de la différenciation de cellules souches induites pour régénérer un organe ou un tissu. Ainsi, il est difficile de contrôler réellement l'état de différenciation de ces cellules adultes, car nous ne savons pas si elles ont toutes perdu leur pluripotencepluripotence. N'y a-t-il pas possibilité qu'une cellule souche induite résiduelle ne se cache au sein de ces cellules adultes, et, ayant gardé sa propriété de pluripotence, se différencie anarchiquement en différents types de cellules adultes entraînant de facto la formation d'un tératometératome (tumeurtumeur formée de cellules pluripotentes) ?
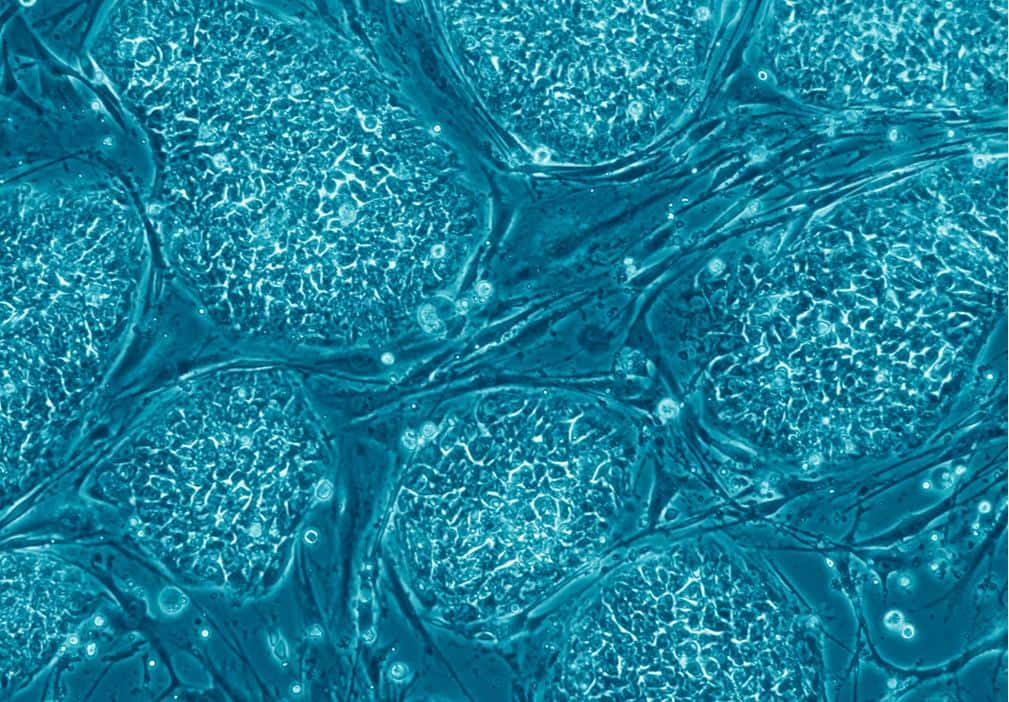
Vers de nouveaux médicaments
Imaginez, grâce à la reprogrammation cellulaire, des neurones, des cellules pancréatiques, des hépatocytes (cellules du foiefoie)... pouvant maintenant être obtenus à partir de la différenciation de cellules souches induites humaines.
Cette technologie a grandement facilité le développement de tests toxicologiques cellulaires pour les médicaments, mais également a permis la simplification de l'analyse des effets thérapeutiques de nouvelles moléculesmolécules sur des cellules humaines inaccessibles auparavant comme des hépatocytes.
Ces cellules souches induites permettent également l'obtention de ce que l'on appelle des « organoïdes », mini-organes en 3D qui tendent à remplacer l'expérimentation animale. Ainsi cette découverte majeure qu'est la reprogrammation cellulaire profite grandement à l'industrie pharmaceutique.
Le saviez-vous ?
Les organoïdes sont des mini-organes créés en laboratoire pour réaliser des expériences, par exemple pour tester des médicaments ou étudier des maladies. Pour fabriquer un organoïde, les scientifiques placent des cellules souches dans une matrice qui permettra la culture tridimensionnelle. En plus des minicerveaux, il est possible de créer des mini-estomacs, minirétines, minipancréas, minifoies,etc.
De nouvelles thérapies
Pour aller plus loin, non seulement les différents types de cellules humaines adultes dites « normales » sont accessibles, mais également celles issues de patients. Ainsi il est maintenant possible de générer des modèles cellulaires mimant les maladies. Ces derniers permettent de pouvoir appréhender les mécanismes physiopathologiques à l'origine de la maladie, mais également de développer de nouvelles thérapeutiques plus ciblées.
Le premier exemple est celui de la modélisationmodélisation cellulaire de l'anémie de Fanconi qui, grâce à la reprogrammation cellulaire, a permis de comprendre et de corriger le défaut de production de cellules sanguines, qui est une des caractéristiques de cette maladie.
De plus, les cellules souches induites issues de patients souffrant de maladies génétiquesmaladies génétiques sont d'excellents modèles cellulaires pour tester de nouvelles thérapeutiques telles que l'édition du génomeédition du génome. L'idée est de venir corriger spécifiquement le défaut génétique au sein de la cellule souche induite du patient pour pouvoir ultérieurement réinjecter la cellule corrigée. La preuve de concept de cette approche a pu être validée dans une maladie génétique rare de l'immunodéficienceimmunodéficience innée nommée granulomatose septique chronique.
“L’idée est de venir corriger spécifiquement le défaut génétique au sein de la cellule souche induite du patient pour pouvoir ultérieurement réinjecter la cellule corrigée”
Notre laboratoire développe également une nouvelle approche thérapeutique de cette maladie, une thérapiethérapie protéique. La granulomatose septique chronique est une maladie raremaladie rare due à un déficit en une enzyme cléenzyme clé de la défense contre les infections bactériennes, nommée NADPH oxydaseoxydase ou NOXNOX, elle est localisée dans la membrane des globules blancsglobules blancs comme les macrophagesmacrophages ou les neutrophilesneutrophiles. Grâce à cette enzyme NOX, ces globules blancs produisent des molécules pour tuer les bactériesbactéries ou les champignonschampignons responsables d'infections de nos tissus ou organes. La prévalenceprévalence de cette maladie en France et dans le monde est de un cas pour 250.000 individus.

La première cause de décès de ces patients étant les infections pulmonaires sévères, l'idée est de produire artificiellement l'enzyme déficiente NOX incorporée dans une enveloppe lipidique qui sera, à terme, administrée en aérosolaérosol nasal pour restaurer l'activité enzymatiqueenzymatique des macrophages pulmonaires du patient. Pour cela, nous avons générer les modèles cellulaires mimant la granulomatose septique chronique, c'est-à-dire des macrophages déficients en NOX, issus de cellules souches induites obtenues à partir des patients atteints de cette maladie. La preuve de concept de l'efficacité de cette approche thérapeutique a été réalisée dans notre modèle cellulaire pathologiquepathologique. La preuve de son efficacité contre des infections pulmonaires chez la souris sera la prochaine étape.
L’immortalité, c’est pour bientôt ?
Le problème majeur de cette technique est qu'elle ne fait pas que rajeunir les cellules, mais elle modifie également leur identité. En effet, une cellule épithéliale adulte par exemple va devenir une cellule souche par reprogrammation cellulaire puis, ce n'est que dans un deuxième temps qu'elle sera différenciée en cellule d'intérêt (une cellule cardiaque par exemple).
Le passage par le stade cellule souche entraîne un risque non négligeable de développement de tumeurs. Ceci est illustré par les travaux de Juan Carlo Izpisua Belmonte publiés en 2016 sur le prolongement de la durée de vie de souris atteintes de vieillissement prématuré par reprogrammation cellulaire. En effet, bien que l'effet escompté ait été obtenu chez certaines souris, d'autres ont développé des tumeurs.
La reprogrammation cellulaire possède un énorme potentiel de développement pour améliorer la santé humaine en facilitant les tests toxicologiques développés par l'industrie pharmaceutique. Elle permet également la modélisation de maladies en vue de leur compréhension et pour tester de nouvelles approches thérapeutiques. Cela dit, il est clair que des travaux de recherche fondamentale visant à comprendre parfaitement les mécanismes moléculaires de la reprogrammation cellulaire sont nécessaires pour une maîtrise des risques cancérigènes, et ce, afin de sécuriser son applicationapplication en médecine régénératrice.
Pour l'instant, aucun essai cliniqueessai clinique chez l'humain n'est donc raisonnablement envisageable. Malgré les rêves des plus fortunés, le rajeunissement humain n'est pas pour demain.