au sommaire
L'intestin est un organe essentiel du corps humain. Il constitue la principale interface d'échanges avec le monde externe au moyen d'une surface équivalente à deux terrains de tennis. Au vu de son importance, il possède son propre système nerveux et est depuis quelques années communément appelé « le deuxième cerveau ». Le système nerveux entériqueentérique contrôle de nombreuses fonctions incluant le mélange et la propulsion du bol alimentaire au long du tube digestif, la sécrétion d'hormones, la perméabilité épithéliale. Les perturbations de ce système sont à l'origine de nombreuses pathologiespathologies. Son mauvais fonctionnement gêne en effet la contraction des muscles intestinaux. Ceci contribue à déclencher des douleursdouleurs abdominales, des diarrhéesdiarrhées, des constipationsconstipations et dans les cas graves, crée des obstructions fonctionnelles (occlusions intestinales) qui requièrent une intervention chirurgicale.
Il n'existait, jusqu'alors, aucun modèle biologique pour l'étudier chez l'Homme. Des chercheurs du Cincinnati Children's Hospital Medical Center et de l'Inserm (Unité mixte de recherche 913 « Neuropathies du système nerveux entérique et pathologies digestives », Inserm, université de Nantes) ont donc développé une approche innovante d'ingénierie tissulaire associée à l'utilisation de cellules souchescellules souches pour créer un intestin humain fonctionnel. Leurs travaux paraissent dans Nature Medicine.
L'équipe a ajouté successivement un cocktail de moléculesmolécules destinées à diriger la différentiationdifférentiation des cellules souches pluripotentes humaines en tissu intestinal. Le processus était quasiment le même que celui utilisé en 2010 puis 2014 par le même laboratoire qui a réussi à mettre au point la toute première génération de tissus intestinaux humains. Mais, avec cette seule approche, les tissus intestinaux ne possédaient pas de système nerveux entérique, indispensable à l'absorptionabsorption des nutrimentsnutriments et à l'évacuation des déchetsdéchets au travers des voies digestives.
En parallèle, et afin de concevoir un système nerveux fonctionnel, les chercheurs ont donc créé des cellules nerveuses au stade embryonnaire appelées cellules de la crête neurale. Ces dernières ont été manipulées pour former des cellules, précurseurs des cellules nerveuses entériques. « La difficulté de cette étape était d'identifier comment et quand incorporer les cellules de la crête neurale dans l'intestin en développement précédemment créé in vitroin vitro » explique Maxime Mahé, chargé de recherche à l'Inserm, coauteur de ce travail. La co-culture du tissu intestinal et des cellules précurseurs du système nerveux entérique a permis de générer un tissu humain ressemblant à l'intestin fœtal en développement. Il en a résulté la première génération de « mini-intestins » (appelés organoïdes intestinaux) complexes et fonctionnels, entièrement issus de cellules souches pluripotentes humaines.
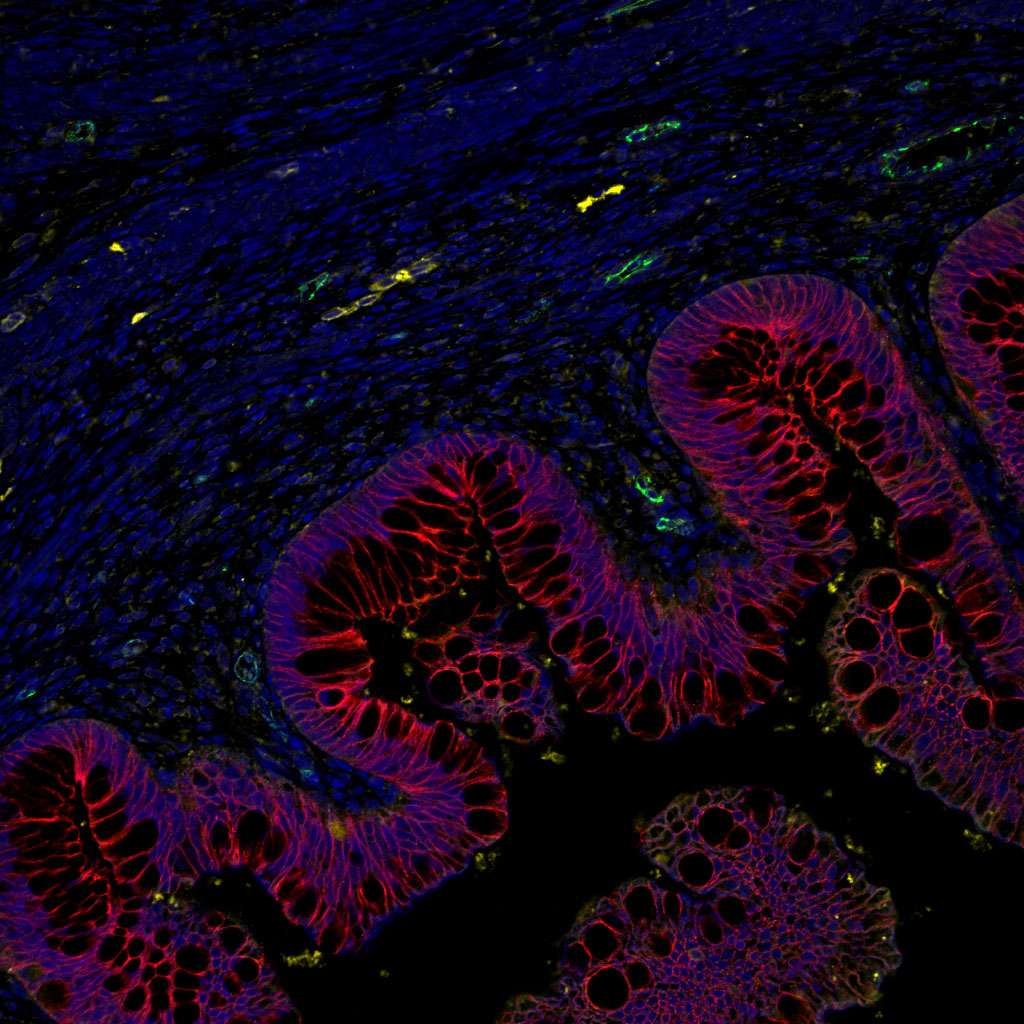
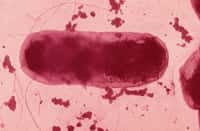
Cette image montre une coupe transversale d’un organoïde intestinal humain après transplantation chez la souris. L’épithélium intestinal apparaît en rouge. © Maxime M. Mahe, CCMH
L’intestin fabriqué in vitro est greffé chez la souris
Le défi suivant a été de transplanter ces organoïdes fonctionnels dans un organisme vivant, dans ce cas, des souris de laboratoiresouris de laboratoire dépourvues de système immunitairesystème immunitaire. Cette étape a permis aux chercheurs d'observer le développement et le fonctionnement des tissus in vivoin vivo. Les données de l'étude montrent que les tissus fonctionnent et sont structurés d'une manière remarquablement similaire à celle d'un intestin humain. Ils se développent et assurent les fonctions intestinales, telles que le traitement des nutriments. Ils présentent enfin une motricité similaire au péristaltismepéristaltisme - c'est-à-dire des séries de contractions musculaires qui déplacent les aliments au travers des voies digestives.
Les chercheurs ont ensuite utilisé cette technologie pour étudier une maladie intestinale rare : la maladie de Hirschsprung - une affection dans laquelle le rectumrectum et le côloncôlon ne développent pas de système nerveux, entraînant constipation et occlusion intestinale. Une forme létale de la maladie de Hirschsprung est provoquée par une mutation du gènegène PHOX2B. Leurs tests in vitro et chez des souris leur ont permis de démontrer que le gène PHOX2B muté provoque des changements délétères importants dans les tissus intestinaux innervés.
Cette découverte apporte deux grandes perspectives de recherche. La première sera de modéliser et étudier les troubles intestinaux dans un tissu humain tridimensionnel et fonctionnel, et ce, avec des cellules spécifiques d'un patient. La seconde perspective consistera à tester les nouvelles thérapiesthérapies sur cet intestin humain fonctionnel avant de proposer des essais cliniquesessais cliniques chez l'Homme.
----------
Votre intestin recréé dans un labo ?
Article initial de Claire PeltierClaire Peltier paru le 14/12/2010
Un nouvel organe vient d'être recréé en laboratoire. Il s'agit cette fois d'un intestin obtenu à partir de cellules souches soumises à l'action d'hormones. L'« organoïde » présente toutes les caractéristiques d'un vrai intestin et pourrait être utilisé dans la recherche de molécules thérapeutiques, voire pour des greffesgreffes.
La reconstitution d'organes in vitro est de plus en plus recherchée. À cause du manque de donneurs d'organes, mais aussi tout simplement pour le stimulant défi que cela représente, les chercheurs font preuve d'ingéniosité pour imiter mère Nature. Après les poumons, c'est au tour de l'intestin d'être reconstitué en laboratoire.
Si l'intestin semble à priori moins complexe que le poumonpoumon, puisqu'il ne s'agit apparemment « que » d'un long tube, il est tout de même composé d'un grand nombre de types cellulaires différents. En effet, l'intestin a pour fonction de digérer les aliments, en absorbant les nutriments via l'épithéliumépithélium intestinal, tout en assurant le mouvementmouvement péristaltique du bol alimentaire ; des fonctions assurées par des cellules spécialisées.
Les scientifiques sont partis de cellules pluripotentes, en théorie capables de générer toute sorte de tissu. Les deux grands types de cellules souches ont été utilisées : les cellules souches embryonnairescellules souches embryonnaires (ou CSE, naturellement pluripotentes puisque provenant d'embryonsembryons) et les cellules souches pluripotentes induites (ou CSPiCSPi, rendues pluripotentes grâce à des manipulations génétiquesgénétiques).
Des cellules souches sous contrôle hormonal
S'appuyant sur des données antérieures, les chercheurs ont reconstitué la chronologie de l'expression des différents facteurs de croissancefacteurs de croissance au cours du développement embryonnaire. Ceux-ci ont des rôles précis à des moments clés, qui permettent un développement très organisé des tissus embryonnaires grâce à l'activation de l'expression de gènes spécifiques.
Ainsi, les cellules souches ont été mises pendant trois jours en présence d'activine A, une protéineprotéine impliquée dans le développement de l'endodermeendoderme. Ce feuillet embryonnaire donne progressivement naissance à une partie des organes internes dont l'intestin, par opposition à l'ectodermeectoderme et au mésodermemésoderme qui se différencient respectivement en tissus plus externes (peau, yeuxyeux...) ou médians (vaisseaux sanguins, os, muscles striés...).
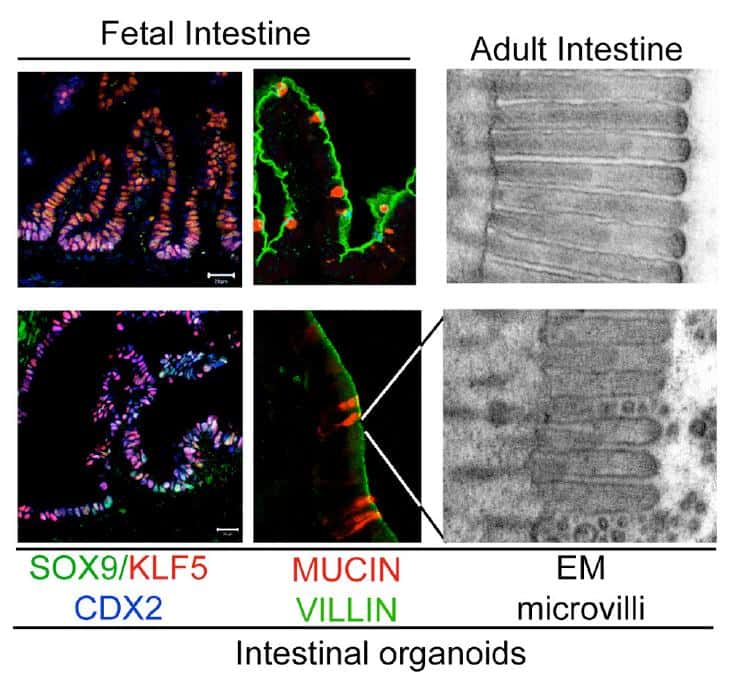
Les intestins synthétisés in vitro (images du bas) ressemblent beaucoup aux intestins formés naturellement chez la souris (images du haut). Les mêmes gènes sont activés (images en couleurs), et des microvillosités sont également visibles (image en noir et blanc). © Nature
Deux facteurs impliqués dans la différenciation de l'intestin postérieur (FGF4 et Wnt3) ont ensuite été inclus dans le milieu de culture des cellules pendant quatre jours, suffisamment pour que la couche cellulaire commence à s'enrouler spontanément pour former un tube creux. Pour favoriser les dernières étapes (croissance intestinale, morphogenèsemorphogenèse et différenciation cellulaire), les tissus obtenus ont été placés sous l'influence de nouvelles hormones (EGF, noggin et R-spondin).
Un intestin in vitro, presque aussi vrai que nature
Au final, les chercheurs ont réussi à obtenir un « organoïde » tridimensionnel dont les propriétés le rendent similaire à un intestin :
- une forme creuse ;
- une couche polarisée de cellules épithéliales spécialisées, comme un intestin classique, en entérocytes (cellules qui sont spécialisées dans l'absorption des nutriments), en cellules entéroendocrines (qui expriment des hormones), en cellules caliciformes (qui assurent la sécrétion de mucusmucus) et en cellules de Paneth (des défenseurs de l'intestin) ;
- la présence de microvillosités ;
- la présence de cellules de la crypte intestinale (une source de cellules souches prêtes à remplacer les cellules intestinales détruites) ;
- une couche de cellules musculairescellules musculaires.
Ces résultats, publiés dans la revue Nature, sont une vraie avancée dans le domaine. C'est en effet la première fois qu'il est possible de recréer l'ensemble des types cellulaires d'un organe par cette méthode. Cela permet d'imaginer l'utilisation de cet organoïde dans le but de tester de nouvelles molécules thérapeutiques, ou de mieux comprendre les maladies intestinales. Si la méthode fait ses preuves, des greffes autologues (à partir des cellules du patient) pourront également être envisagées, notamment pour les patients souffrant de malformations congénitalesmalformations congénitales.