Les scientifiques se sont intéressés au système immunitaire inné et ont découvert que celui-ci conservait en mémoire la trace des infections passées afin d'activer rapidement une réponse immunitaire plus efficace. La découverte du mécanisme et la compréhension de la fonction des cellules souches sanguines ouvriraient de nouvelles pistes thérapeutiques et vaccinales, notamment dans la lutte contre le Covid-19.
au sommaire
C'est un fait connu de longue date : le système immunitaire adaptatif a une mémoire. Ainsi, les lymphocytes deviennent spécifiques d'un agent pathogène particulier à éliminer après y avoir été exposés lors d'une infection et certains d'entre eux subsistent durablement dans l'organisme. Les principes de la vaccination reposent sur la connaissance de ces mécanismes immunitaires.
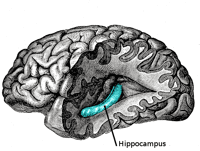
Plus récemment, des travaux ont suggéré que le système immunitaire inné, qui permet la défense de l'organisme de façon immédiate suite à une infection, a lui aussi une forme de mémoire. Des chercheurs ont, par exemple, montré que le système immunitaire inné continue d'être plus efficace en cas de réinfection malgré la duréedurée de vie très courte des cellules immunitaires, comme les monocytes ou les granulocytesgranulocytes. Ils ont alors soupçonné que cette mémoire du système immunitaire inné était en fait inscrite dans les cellules souchescellules souches sanguines, dont la durée de vie est très longue, et qui sont à l'origine de différentes cellules immunitaires matures.
Les propriétés surprenantes des cellules souches sanguines
Pour vérifier cette hypothèse, les chercheurs du Centre d'immunologie de Marseille-Luminy (CNRS/Inserm/Aix-Marseille Université) et du Centre des thérapiesthérapies régénératives de l'Université technique de Dresde (Allemagne) ont effectué des travaux dont les résultats sont publiés dans Cell Stem Cell.
L'équipe a exposé des souris à une moléculemolécule de surface de la bactériebactérie E. coliE. coli (lipopolysaccharidelipopolysaccharide ou LPS), un agent pathogène largement utilisé pour mimer des infections en laboratoire. Ensuite, les chercheurs ont transféré des cellules souches sanguines prélevées chez ces animaux à d'autres souris non infectées et dont le système immunitaire avait préalablement été détruit. Le but était de reconstituer entièrement leur système immunitaire à partir de ces cellules souches.
“Le but était de reconstituer entièrement leur système immunitaire à partir de ces cellules souches”
Les chercheurs ont ensuite infecté des souris de ce groupe avec une bactérie vivante de l'espèceespèce P. aeruginosa et ont constaté que le taux de mortalité n'était que de 25 %. Il atteignait en revanche 75 % chez des souris contrôles, dont les cellules souches n'avaient jamais été exposées à un agent pathogène. « Ce travail démontre de façon forte que les cellules souches sanguines ont une fonction de mémoire qu'on ne soupçonnait pas. Une première exposition à un pathogène les arme pour mieux affronter une prochaine infection », explique Sandrine Sarrazin.
Le rôle majeur de la protéine C/EBP
Ce mécanisme n'est pas spécifique d'un agent pathogène puisque, dans une autre expérience, une première exposition des cellules souches sanguines à un antigèneantigène viral a protégé les souris contre une exposition secondaire à P. aeruginosa. De manière surprenante, les scientifiques ont donc découvert que la protection apportée par cette mémoire du système immunitaire s'étend au-delà du seul agent infectieux utilisé pour la première infection.
Les chercheurs se sont ensuite intéressés à la manière dont cette mémoire était codée. En étudiant le génomegénome des cellules souches sanguines des souris infectées, ils ont constaté des modifications durables dans son organisation spatiale. Ces changements étaient susceptibles de modifier l'expression de certains gènesgènes impliqués dans la réponse immunitaire innée.
« Lors du premier contact avec l'agent pathogène, des gènes requis pour la réponse immunitaire sont en fait durablement mis en avant pour activer rapidement le système immunitaire lors d'une deuxième infection », explique Bérengère de Laval, première auteure de l'étude. Enfin, l'équipe a recherché des molécules impliquées dans ce changement de structure du génome et a découvert qu'une protéineprotéine appelée C/EBP bêtabêta jouait un rôle majeur.
Des recherches pertinentes en période de lutte contre le Covid-19
Ces résultats résonnent tout particulièrement en cette période de pandémiepandémie du coronaviruscoronavirus SARS-Cov-2SARS-Cov-2. Des observations récentes suggèrent que le vaccinvaccin BCGBCG, connu pour induire lui aussi une mémoire immunitaire innée, agirait également au niveau des cellules souches sanguines et offrirait un certain degré de protection contre les infections respiratoires. Des études sont en cours pour tester son utilité contre le Covid-19Covid-19.
Les découvertes de l'équipe pourraient éclairer les mécanismes en jeu dans cette protection au niveau moléculaire et ouvrir de nouvelles pistes vaccinales, y compris contre le Covid-19.
« Nos découvertes représentent une contribution majeure à la compréhension de la mémoire du système immunitaire et des fonctions des cellules souches du sang. Elles orientent en outre vers de nouvelles stratégies pour stimuler ou limiter la réponse immunitaire dans divers états pathologiquespathologiques, et pourraient permettre d'affiner les stratégies de vaccination actuelles pour une meilleure protection face à divers agents pathogènes, y compris contre le SARS-CoV-2 », espère Michael Sieweke.
Les étranges cellules humaines en 17 photos
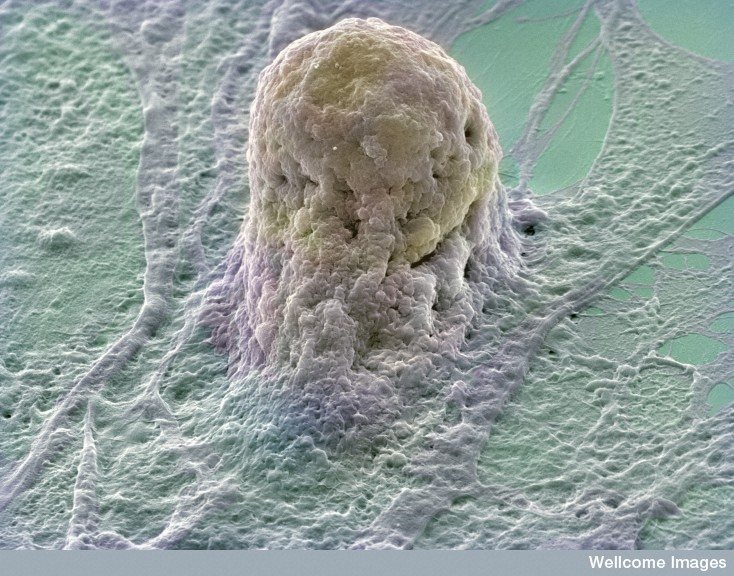
Un spermatozoïdespermatozoïde et un ovuleovule se rencontrent avant de fusionner : ainsi naît la cellule œuf, ou zygotezygote, la première cellule à l'origine de toutes les autres.
Elle se divise une première fois, une deuxième fois, puis à une infinité de reprises. Sous l'influence des gènesgènes, ces cellules naissantes vont peu à peu se différencier et se spécialiser afin de parvenir à cette diversité qui caractérise les organismes complexes que nous sommes.
- Taille : environ 100 µm ;
- Un seul noyau ;
- Première cellule de l'organisme.
© Yorgos Nikas, Wellcome Images, Flickr, CC by-nc-nd 2.0