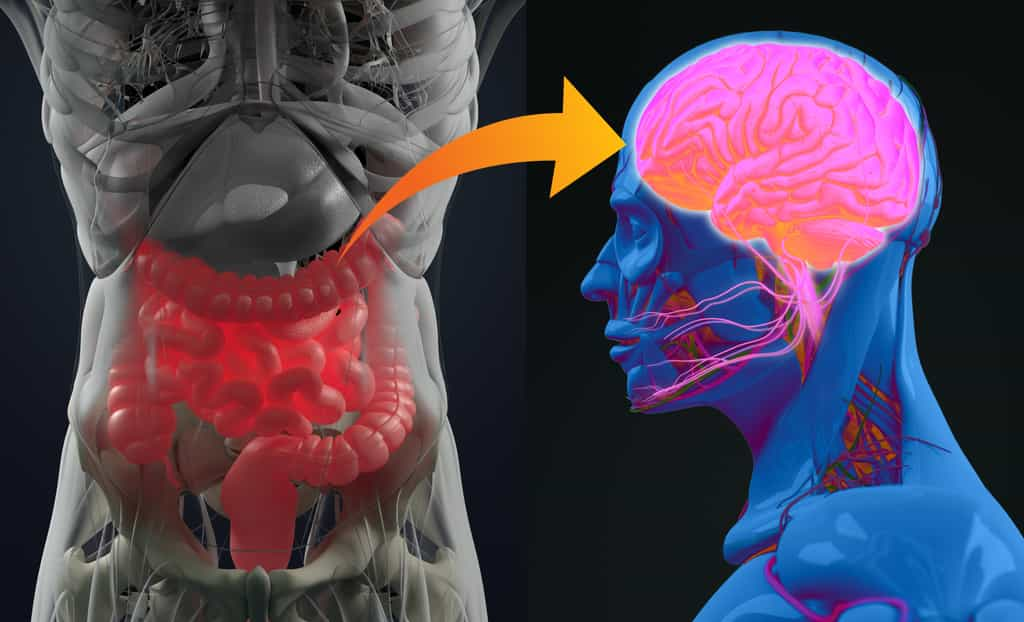
Immunité, métabolisme et fonctions cérébrales seraient-ils modulés directement par l’activité bactérienne du microbiote intestinal ? Une équipe de scientifiques découvre que des neurones de l'hypothalamus détectent directement les variations de l’activité bactérienne du microbiote intestinal et régulent en conséquence l’appétit et la température corporelle ouvrant de nouvelles voies vers d'autres approches thérapeutiques contre les troubles métaboliques, dont le diabète ou l’obésité.
au sommaire
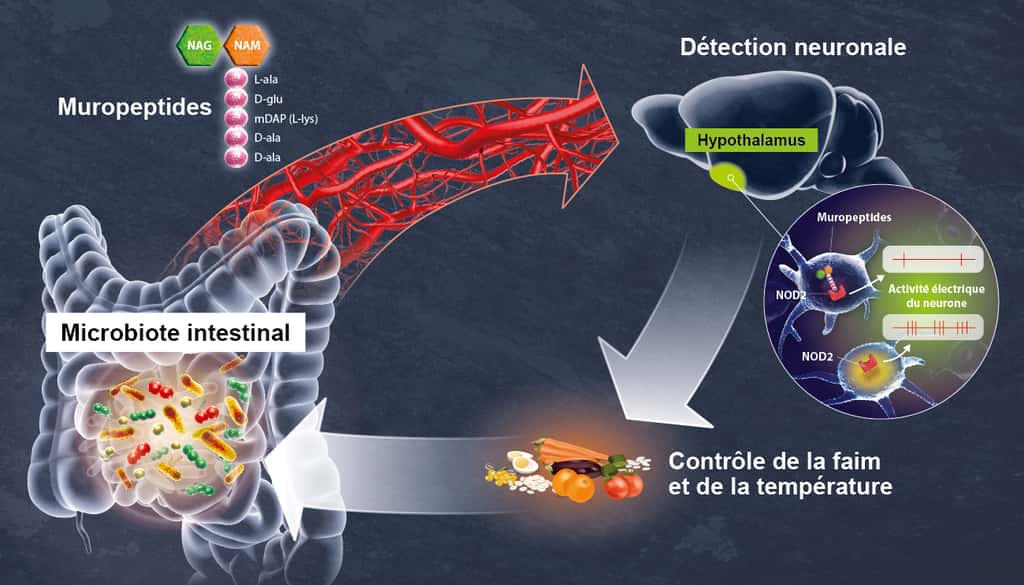
Le microbiote intestinal constitue le plus grand réservoir de bactéries de l'organisme. De plus en plus de travaux montrent combien l'hôte et son microbiote intestinal sont dépendants l'un de l'autre, et soulignent l'importance de l'axe intestin-cerveau. À l'Institut Pasteur, des neurobiologistes de l'unité Perception et mémoire (Institut Pasteur/CNRS), des immunobiologistes de l'unité Microenvironnement et immunité (Institut Pasteur/Inserm), et des microbiologistes de l'unité Biologie et génétique de la paroi bactérienne (Institut Pasteur/CNRS/Inserm) ont mis en commun leurs expertises pour comprendre comment les bactéries de l’intestin peuvent avoir un effet direct sur l'activité de certains neuronesneurones du cerveau.
Les scientifiques se sont intéressés particulièrement au récepteur NOD2 (Nucleotide Oligomerization Domain) qui est présent à l'intérieur des cellules, en particulier des cellules immunitaires. Ce récepteur détecte la présence de muropeptides, des composés des parois bactériennes, qui peuvent être considérés comme les produits dérivés du microbiote intestinal. Par ailleurs, il était déjà connu que des variants du gènegène codant pour le récepteur NOD2 sont associés à certaines maladies du système digestif, telles que la maladie de Crohnmaladie de Crohn, mais aussi à certaines maladies neurologiques ou troubles de l’humeur.
Quand le récepteur récepteur NOD2 est défaillant
Ces données ne permettaient pas encore de conclure à un rapport direct entre le fonctionnement des neurones du cerveau et l'activité bactérienne de l'intestin. C'est ce qu'a mis en lumièrelumière le consortium de scientifiques dans cette nouvelle étude, publiée dans Science le 15 avril dernier.
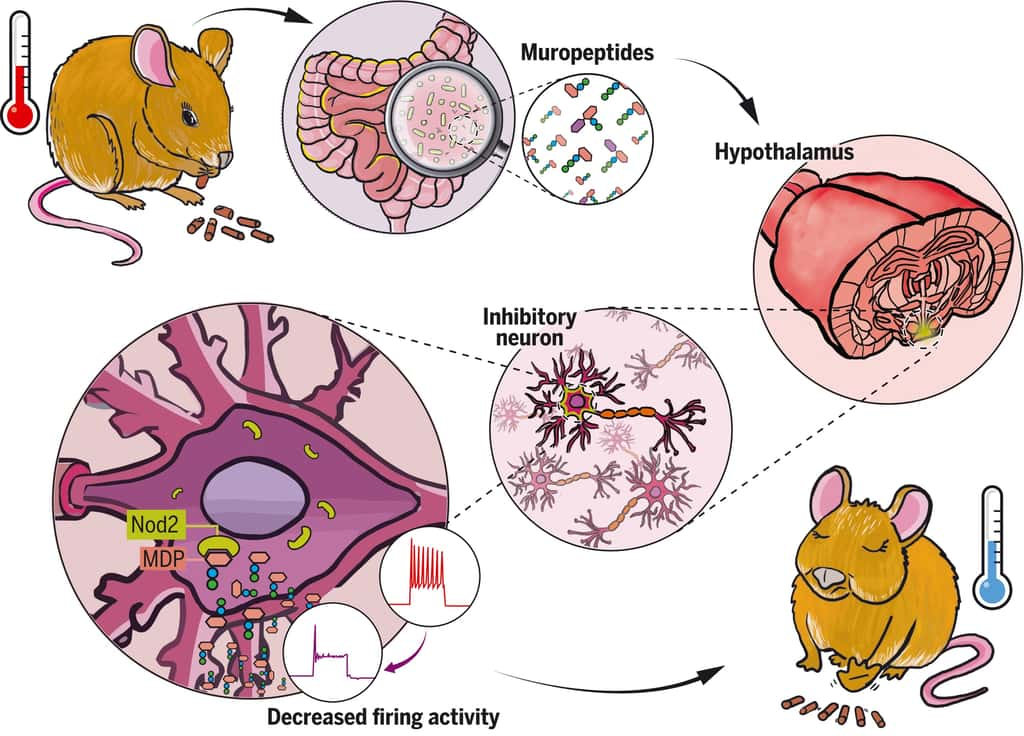
Grâce à des techniques d'imagerie cérébrale, les scientifiques ont tout d'abord observé, chez la souris, que le récepteur NOD2 est exprimé par des neurones de différentes régions du cerveau, et en particulier dans un centre nommé l'hypothalamushypothalamus. Ils ont ensuite découvert que ces mêmes neurones voient leur activité électrique réprimée lorsqu'ils rencontrent des muropeptides bactériens issus de l'intestin. Les muropeptides sont libérés par les bactéries lorsqu'elles prolifèrent.
« Les muropeptides présents dans l'intestin, le sang et le cerveau sont considérés comme les marqueurs de la prolifération bactérienne », explique Ivo G. Boneca, responsable de l'unité Biologie et génétique de la paroi bactérienne à l'Institut Pasteur (CNRS/Inserm).
À l'inverse, dans le cas où le récepteur NOD2 est défaillant, ces neurones ne sont plus réprimés par les muropeptides ; le cerveau perd alors le contrôle de la prise alimentaire et de la température corporelletempérature corporelle. En conséquence, les souris prennent du poids et sont plus susceptibles à développer un diabètediabète de type 2, en particulier chez les femelles âgées.
Une nouvelle approche thérapeutique contre les troubles métaboliques ou neurologiques
Chose étonnante, les scientifiques ont montré ici que ce sont les neurones qui perçoivent directement les muropeptides bactériens, alors que cette tâche est généralement dévolue aux cellules du système immunitaire. « Il est stupéfiant de découvrir que des fragments bactériens agissent directement sur un centre nerveux aussi stratégique que l'hypothalamus, connu pour gérer des fonctions vitales comme la température corporelle, la reproduction, la faim, ou la soif », commente Pierre-Marie Lledo, chercheur CNRS et responsable de l'unité Perception et mémoire à l'Institut Pasteur.
Ainsi, les neurones semblent détecter l'activité bactérienne (la prolifération et la mort) pour mesurer directement l'impact de la prise alimentaire sur l'écosystèmeécosystème intestinal. « Il est possible qu'une prise alimentaire excessive ou un aliment particulier favorise l'expansion exagérée de certaines bactéries ou de pathogènespathogènes, et mette ainsi en danger l'équilibre intestinal », souligne Gérard Eberl, responsable de l'unité Microenvironnement et immunité à l'Institut Pasteur (Inserm).
Étant donné l'impact des muropeptides sur les neurones de l'hypothalamus et le métabolismemétabolisme, on peut s'interroger sur leur rôle dans d'autres fonctions du cerveau, et ainsi comprendre l'association entre certaines maladies du cerveau et les variants génétiques de NOD2. Cette découverte ouvre la voie à de nouveaux projets interdisciplinaires pour les trois équipes de recherche et à terme, à de nouvelles approches thérapeutiques contre les maladies du cerveau, ou les maladies métaboliques comme le diabète et l'obésitéobésité.
Un lien entre les cellules de notre cerveau et de nos intestins
Les cellules souchescellules souches sont indispensables à la régénération de cellules endommagées, malades ou vieillissantes. Et des chercheurs montrent aujourd'hui l'existence d'une hormonehormone commune au maintien d'un fonctionnement optimal de cellules souches différentes, présentes dans les intestins et le cerveau.
Article de Nathalie MayerNathalie Mayer, publié le 18 avril 2019
Il y a quelques mois, une étude faisait état d'une connexion neuronale entre notre cerveau et nos intestins. Aujourd'hui, des chercheurs de l'université de Rutgers (États-Unis) semblent vouloir faire un lien nouveau entre ces deux organes essentiels à notre santé : les cellules souches. Ou plutôt une hormone essentielle au maintien des cellules souches à la fois dans le cerveau et dans les intestins.
Rappelons qu'une prolifération de cellules souches dans l'intestin peut conduire à l'apparition d'un cancer colorectal. Au niveau du cerveau, le phénomène peut provoquer des troubles de l’anxiété ou des troubles cognitifs. Et les chercheurs mettent aujourd'hui en avant l'importance d'un seul et même facteur de croissancefacteur de croissance-2 analogue à l'insulineinsuline (IGF-II).
Un même facteur pour différentes cellules souches
« La découverte qu'il existe un facteur commun à plusieurs populations de cellules souches adultes est remarquable », commente Steven Levison. Celui-ci serait ainsi essentiel à la fonction cognitive, au sens de l’odorat et au renouvellement de la muqueusemuqueuse de l'intestin grêleintestin grêle chez l'adulte.
Pour en arriver à ces conclusions, les chercheurs ont supprimé, chez des souris, le gène responsable de la production d'IGF-II. Une suppression rapide de ce gène a entraîné la mort des souris en une semaine, après des pertes de poids spectaculaires. Une suppression plus lente du gène a permis aux souris de survivre - d'autres cellules souches présentes dans l'intestin ayant pris le relais -, mais avec des déficits d'apprentissage et de mémoire, une anxiété accrue et une perte de l'odoratodorat, une moitié de cellules souches neurales ayant été perdues dans deux zones du cerveau.
Votre intestin est directement relié à votre cerveau
Des chercheurs ont démontré l'existence d'une connexion neuronale entre l'intestin et le tronc cérébraltronc cérébral, situé juste en dessous du cerveau. Jusqu'à présent, seule une communication hormonale, plus lente, avait été décrite pour expliquer le contrôle de la faim.
Article de Marie-Céline RayMarie-Céline Ray paru le 24/09/2018
Notre cerveau reçoit des informations en provenance de nos cinq sens : la vision, l'ouïe, le toucher, le goût et l'odorat. Ces messages sont rapidement transportés grâce à des fibres sensorielles qui transmettent des messages électriques : c'est ainsi que, dès que vous ouvrez la porteporte de votre maison, vous pouvez voir le désordre dans votre salon ou sentir immédiatement une bonne odeur de gâteau au chocolat en train de cuire.
L'intestin doit lui aussi envoyer des messages au cerveau pour lui dire s'il est plein ou non, s'il faut manger ou pas. Pour cela, il utilise des messages hormonaux, c'est-à-dire des moléculesmolécules libérées dans le sang. Au niveau de l'épithéliumépithélium intestinal, il existe des cellules appelées « entéroendocrines » qui servent de capteurscapteurs sensoriels, et « sentent » les nutriments présents. Les nutrimentsnutriments présents dans l'intestin stimulent la libération d'hormones, pour informer le cerveau, mais des minutes, voire plus, après l'ingestioningestion de nourriture.
Jusqu'à présent on pensait que ces cellules sensorielles n'agissaient que par la voie lente des hormones comme la cholécystokininecholécystokinine. Les chercheurs suspectaient l'existence d'un mécanisme plus rapide car les cellules sensorielles présentes au niveau de l'intestin ont des similitudes avec celles de la langue et du neznez. Par exemple, ces cellules émettent un signal électrique, si elles sont stimulées.
Le saviez-vous ?
Le système nerveux entérique comprend des millions de neurones disposés le long du tube digestif. Il sert à commander les contractions de l’intestin. Le nerf vague assure la communication entre le cerveau et ce système nerveux parfois qualifié de « second cerveau ».
Dans cette nouvelle recherche parue dans Science, les chercheurs de l'université de Duke voulaient mieux comprendre le circuit qui relie l'intestin et le cerveau. Pour cela, ils ont utilisé un virusvirus de la ragerage marqué avec une fluorescence verte qu'ils ont injecté dans l'estomacestomac de souris afin de suivre son trajet de l'intestin au cerveau. Le virus de la rage est connu pour infecter des neurones.
Des cellules intestinales ont des synapses avec le système vagal
Les chercheurs ont observé que le virus passait par le nerf vaguenerf vague pour arriver au tronc cérébral et il n'y avait qu'une seule synapsesynapse entre l'intestin et le tronc cérébral ! De plus, les chercheurs ont montré que les cellules entéroendocrines avaient des protéinesprotéines présynaptiques. In vitroIn vitro, ils ont cultivé ces cellules sensorielles intestinales avec des neurones de nerf vague de souris : les neurones se connectaient aux cellules intestinales. Les chercheurs ont donné du sucresucre à ces cellules pour créer un stimulus : un message était transmis des cellules entéroendocrines vers les neurones vagaux grâce aux connexions créées !
Diego Bohórquez, un des auteurs de ces travaux, a déclaré dans un communiqué de l'université Duke « Les scientifiques parlent de l'appétit en termes de minutes et d'heures. Nous parlons ici de quelques secondes. » Or, cela a des implications pour la recherche de thérapiesthérapies contre l'obésité car beaucoup des molécules supprimant l'appétit qui ont été étudiées ciblent des hormones à action lente, et non des synapses à action rapide. « C'est probablement la raison pour laquelle la plupart d'entre elles ont échoué. »
Les chercheurs suspectaient le glutamateglutamate, un neurotransmetteurneurotransmetteur impliqué dans le goût et l'odorat, de jouer un rôle dans la transmission du message. Quand ils ont bloqué la libération de glutamate au niveau des cellules sensorielles intestinales, il n'y avait plus de message. Par conséquent, les cellules entéroendocrines ne jouent pas qu'un rôle hormonal.
Grâce à des synapses avec le nerf vague, ces cellules sensorielles connectent directement la lumière de l'intestin au tronc cérébral, situé à la base du cerveau. Elles envoient des messages rapides sur la présence de nutriments, comme du sucre, en utilisant le glutamate comme neurotransmetteur.