au sommaire
L'antimoine était connu chez les Babyloniens et chez les Chinois et pas seulement comme métal, même si l'on a trouvé des objets d'utilisation datant de 4.000 ans avant Jésus-Christ : le sulfure était administré entre autres comme médicament.
La découverte faite par M. Grand d'un fragment de sulfure d'antimoine dans la caverne de Menton, au milieu d'instruments de silex, d'agates et de quartzquartz hyalinshyalins, semblerait indiquer qu'il était déjà utilisé dès l'âge de pierre.

L'emploi de l'antimoine
On utilisait du sulfure d'antimoine dans l'Antiquité comme mascara, un colorant pour colorer les cilscils et les sourcilssourcils : « Les Syriens, les Babyloniens, les Arabes, les Hébreux et autres nations orientales de l'Antiquité faisaient un fréquent usage du sulfure d'antimoine, non comme agent de travail, mais comme objet de toilette ; c'est bien certainement le plus ancien fard dont il soit fait mention dans l'histoire. Job donne à l'une de ses filles le nom de vase d'antimoine ou de boîte à mettre du fard. Isaïe, dans le dénombrement qu'il fait des parures des filles de Sion, n'oublie pas les aiguilles dont elles se servaient pour peindre leurs paupières, en les trempant dans la poussière noire du minéralminéral en question qu'elles étendaient même jusque sur les sourcils. Ce cercle noir autour des yeuxyeux donnait à ceux-ci une expression plus langoureuse, en même temps qu'il les faisait paraître plus grands. La mode en était si bien établie, que Jézabel ayant appris l'arrivée de Jéhu à Samarie, se mit les yeux dans l'antimoine comme disent les Livres saints, c'est-à-dire les peignit avec du fard, avant de se montrer à cet usurpateur dont elle voulait apaiser la colère » (Girardin, 1873).
Pline a décrit la préparation de l'élément antimoine par réduction du mineraiminerai avec du charboncharbon et d'autres auteurs le mentionnent : « Cet emploi du sulfure d'antimoine ne finit pas avec les filles de Judée ; il s'étendit et se perpétua partout, les femmes grecques et romaines l'empruntèrent aux Asiatiques, et nous voyons Tertullien et Saint Cyprien déclamer contre cette coutume encore usitée de leur temps en Afrique et qui s'est continuée jusqu'à nos jours ».
C'est de cet usage que le sulfure d'antimoine reçut le nom d'alcool, qu'il porta dès les premiers temps historiques. Le terme alcool, appliqué aujourd'hui en chimie au liquideliquide spiritueux qui constitue l'eau-de-vie, fut d'abord donné au sulfure d'antimoine naturel, si l'on en croit Homerus Pop et Thallinus.
Les Romains l'appelèrent ensuite stibium. Les alchimistes le désignaient sous un grand nombre de dénominations absurdes, telles que othia, alkosol, bélier, saturnesaturne des philosophes, fils et gendre de Saturne, etc. ( Girardin, 1873).
Au Moyen Âge, l'antimoine était mentionné par Paracelsus, comme remède. Des techniques de préparation sont décrites dans « Currus triomphalis antimonii », manuel publié vers 1470 par Basilius Valentinus.

Nicolas Lemery (1645-1715) a écrit sur l'antimoine et les pratiques des alchimistes qui le considéraient comme la matièrematière idéale pour accéder à l'or.

Il y a à son propos un très long article dans l'Encyclopédie ou dictionnaire raisonné des sciences des arts et des métiers de Diderot et Alembert. On en parle à l'exposition de 1851.

L'antimoine fut longtemps utilisé comme médicament, entre autres pour les maladies parasitaires.
Quelques préparations chimiques du XIXe selon Girardin (1873)
- Extraction de l'antimoine
On prend du sulfure purifié, on le pulvérise, on le grille dans des fours semblables à ceux qui servent à la conversion du salin en potasse, par charge de 158 kilogrammeskilogrammes au maximum, en ayant soin de rester au-dessous de la chaleurchaleur rouge afin d'éviter la fusionfusion du sulfure.
La plus grande partie du soufresoufre se dégage à l'état d'acideacide sulfureux, avec quelques fumées blanches d'oxyde d'antimoine et d'acide arsénieux, attendu que le minerai, est toujours plus ou moins arsenifère. On remue fréquemment la matière avec un ringard de ferfer pour activer l'oxydationoxydation. L'opération dure environ douze heures. La poudre grise ou un peu rougeâtre qu'on retire du four après son refroidissement est, non de l'oxyde d'antimoine, mais un oxysulfure contenant quelques matières terreuses. On mêle alors cette poudre avec 15 % de charbon arrosé d'une solution de carbonate de soudesoude et on l'introduit dans des creusets qu'on place sur des banquettes construites des deux côtés intérieurs d'un fourneau de galère. On chauffe jusqu'au rouge vif. On recouvre les creusets d'un couvercle pour prévenir l'oxydation. Le charbon réduit l'oxyde d'antimoine, tandis qu'une partie du sulfure se trouve également réduite par l'action combinée du charbon et du sel de soude. Il se forme en même temps à la surface du bain métallique une scoriescorie constituée par un sulfure double de soude et d'antimoine mélangé d'une quantité variable d'oxysulfure qui a échappé à l'action réductrice et de matières terreuses. Quand la réduction est bien opérée, on coule l'antimoine dans des lingotières en fontefonte, et on le refond avec un peu de minerai grillé pour le purifier. On obtient alors le métal en massesmasses hémisphériques du poids de six à huit kilogrammes environ recouvertes, à leur surface convexeconvexe, de belles cristallisations en étoilesétoiles dont les rayons ressemblent à des feuilles de fougèrefougère.
- Préparation du gazgaz acide sulfydrique
On emploie très fréquemment le sulfure d'antimoine dans les laboratoires pour préparer l'acide sulfhydrique. Pour cela, on le traite par 4 à 5 parties d'acide chlorhydriqueacide chlorhydrique dans un appareil convenable. La réaction se comprendra aisément par l'examen de la légende suivante : Sb2S3 + 3HCl ==> Sb2Cl3 + 3 HS.
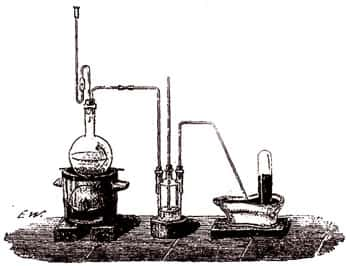
Le gaz sulfhydrique, entraînant toujours avec lui un peu d'acide chlorhydrique, doit, avant d'être recueilli sur la cuve à mercuremercure, passer dans un flacon laveur qui retient l'acide étranger. En place d'eau, on met dans ce flacon une solution concentrée de polysulfure de sodium ou de potassium.
- Chlorure d'antimoine
Le résidu de cette opération consiste en chlorure d'antimoine Sb2Cl3, qu'on peut avoir à l'état solideétat solide, en concentrant la liqueur et le distillant. Le chlorure se volatilise et vient se figer dans le récipient B en une masse blanche, demi-transparente, d'un éclat gras et comme onctueux. C'est cette substance que les alchimistes appelèrent beurre d'antimoine.
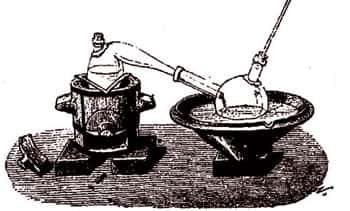
C'est un caustique très violent, dont les médecins se servent souvent pour cautériser certaines plaies, surtout celles produites par la morsuremorsure des animaux enragés ou venimeuxvenimeux. Dans les arts, il est employé pour bronzer les métauxmétaux, et notamment le fer ; les armuriers en font fréquemment usage pour donner aux canons de fusil cette teinte jaune brunâtre, appelé improprement bronzebronze. Il est probable qu'elle est due à une couche d'antimoine métallique qui s'applique à la surface du fer, et qui provient de l'action décomposante que ce dernier métal exerce sur le chlorure d'antimoine.
- Oxychlorure
Ce chlorure ne se dissout dans l'eau qu'autant que celle-ci est très acide et en petite quantité. Cette dissolution donne un beau précipité jaune orangé avec l'acide sulfhydrique ; c'est du sulfure d'antimoine hydraté. Versée dans beaucoup d'eau, elle produit de suite un précipité blanc abondant, grumelé ressemblant assez au lait caillé. C'est que le chlorure d'antimoine, en décomposant l'eau, donne lieu à la formation d'acide chlorhydrique; et d'un oxychlorure d'antimoine insoluble. La légende suivante vous fera très bien concevoir cette réaction curieuse de l'eau sur le composé binairebinaire dont je parle. Cette poudre blanche, cet oxychlorure d'antimoine, fut longtemps nommée mercure de vie, poudre d'Agaroth, du nom d'Algarothi, médecin et chimiste italien, qui l'a, le premier, recommandée et employée comme médicament purgatif et émétiqueémétique.
Sb2Cl3 + 7HO ==> (Sb2Cl2 , Sb2O2, HO) + 6 HCl.
- Noir de fer
Lorsqu'on plonge une lame de zinczinc dans la solution légèrement acide du chlorure d'antimoine, on précipite ce dernier métal sous la forme d'une poudre noire. C'est cette poudre, lavée et, séchée qu'on désigne dans le commerce sous le nom de Noir de fer (Eisenschwarz) ; elle est principalement employée pour enduire les objets en plâtreplâtre et leur donner un aspect de fonte grise. Lorsqu'on fait passer un courant d'hydrogène sulfuréhydrogène sulfuré dans la solution du chlorure d'antimoine, ou lorsqu'on l'additionne de sulfure de sodiumsodium, on obtient un précipité d'une magnifique couleurcouleur jaune orangé, qui n'est autre chose, cependant, que du sulfure d'antimoine hydraté. En chauffant ce précipité à 200 °C il perd son eau, devient noir et cristallin. Il est alors en tout semblable au sulfure naturel.

- Vermillon ou CinabreCinabre d'antimoine
Mais si on ajoute à du chlorure d'antimoine une solution d'hyposulfite de soude, et qu'on chauffe lentement entre 30 et 35 °C en remuant continuellement, jusqu'à ce qu'il ne se dépose plus rien de la liqueur, on obtient du sulfure d'antimoine anhydre qui, au lieu d'être noir est d'un rouge cramoisi d'une beauté extraordinaire. Pour lui conserver cette nuance à l'état sec, on laisse bien égoutter le précipité sur un filtre, on le lavelave avec de l'acide acétique très étendu. On donne à cette modification isomérique du sulfure d'antimoine le nom de Vermillon ou Cinabre d'antimoine. Fuchs a reconnu qu'en faisant refroidir brusquement ce sulfure noir fondu, il devient amorpheamorphe et rouge-brun, moins dense, plus dur, et mauvais conducteur de l'électricité sans avoir pour cela changé de nature chimique ; ce sulfure rouge repasse à l'état de sulfure noir et cristallin par une chaleur de 200 °C.
- Kermès
Quant au kermès des pharmacies, c'est un sulfure d'antimoine divisé, combiné ou associé à une petite quantité de sulfure alcalin et retenant, à l'état de mélange, des proportions variables d'oxyde d'antimoine. Il est d'un rouge-brun foncé et d'un aspect velouté. On l'obtient le plus habituellement en faisant bouillir pendant deux heures environ une partie de sulfure d'antimoine en poudre très fine avec 22 parties et demie de cristaux de soude dans 200 parties d'eau. La liqueur jaune filtrée laisse déposer, par un refroidissement lent, de beaux flocons veloutés de kermès. Le nom de kermès a été imposé par les alchimistes à ce composé à cause de sa couleur qui se rapproche beaucoup de celle que donne à la laine la cochenillecochenille du chêne vertchêne vert nommée par les Arabes kermès, c'est-à-dire petit ver.






























