au sommaire
Les composés du cuivre sont innombrables tant ce métal se lie à tout. Nous allons en voir quelques exemples.

Cu+ (cuivre monovalent) : les composés sont réducteurs, vite oxydés et si on se trouve en solution concentrée on a assez vite : 2 Cu+ -> Cu + Cu2+. Les composés du cuivre monovalent sont en général incolores rouges ou jaunes. Cu+2 donne des composés bleu intense, ils ont une saveur métallique très prononcée, sont toxiques et si le milieu devient basique ils deviennent verts et précipitent. La solubilité du cuivre dans l'eau est fonction entre autres de la concentration en anhydride carbonique, mais aussi de la quantité de sel de mer par exemple ou d'autres chlorures.
On obtient ainsi de l'atacamite : Cu2Cl(OH)3, si on a un milieu basique de la malachite : Cu2(CO3))(OH)2 et si on a un milieu acide de l'azurite : Cu3(CO3)2(OH)2. Tous ces composés existent à l'état naturel et sont le résultat de processus géologiques, en général du thermalisme.

Exemples de composés du cuivre :
1. Les oxydes
On ne sait pas exactement si Cu4O existe, mais en revanche on a obtenu Cu3O (Bailey et Hopkins), une poudre orange, en calcinant CuO à 1.700 °C, mais c'est surtout Cu2O qui peut se fabriquer de nombreuses manières, la cuprite dont le PF = 1.100 °C et d = 6.
L'autre oxyde courant est le CuO. Il est noir et obtenu souvent par oxydation du cuivre, déshydratationdéshydratation de l'hydroxyde ou par électrolyseélectrolyse. À l'état naturel, c'est la mélaconite ou ténorite.
Ce composé est généralement soluble dans une solution alcalinealcaline et donne un complexe anionique selon la réaction suivante :
CuO + OH- <--> HCuO2- <--> H+ + CuO22- (ce dernier est le ionion dominant même à des concentrations de 0,1N).
2. Les hydroxydes
Il n'existe que l'hydroxyde bleu Cu(OH)2 insoluble dans l'eau. S'il est sec et pulvérent il est nommé bleu de Brême.

Les hydroxydes de cuivre se trouvent souvent sous forme de complexes divers spécialement dans l'altération des bronzesbronzes, par exemple :
- hydroxyde sulfate de cuivre (II) - brochantite : Cu4(SO4)(OH)6 ;
- hydroxyde sulfate de cuivre (II) - antlérite : Cu3(SO4)(OH)4 ;
- chlorure hydroxyde de cuivre (II) - atacamite : Cu2(OH)3Cl ;
- chlorure hydroxyde de cuivre (II) - paratacamite : Cu2(OH)3Cl ;
Mais aussi des complexes du type :
Na2 [Cu ( OH)4] ou encore Ba2 [Cu ( OH)6] et d'autres encore.

3. Les chlorures
On trouve le CuCl, ou nantoquite du Chili ou nantokite, dans les fumerolles volcaniques, une découverte en 1868 par Breithaupt à Nankoro, au Chili.
Le CuCl2, lui, est une poudre jaune ou marron de densité égale à 3,05 de PF 498 °C et cristallise dans le système monocliniquesystème monoclinique : la tolbachite.

Elle est souvent associée dans les fumerollesfumerolles volcaniques à de la mélanothallite et s'altère facilement en ériochalcite.

Les chlorures sont facilement hydratés avec un ou plusieurs H2O. Mais les chlorures aussi forment facilement des ions complexes en milieu aqueuxaqueux, par exemple : [Cu(H2O)n ]2+ + 2 Cl-.
4. Les oxychlorures
Le chlorite Cu(ClO2)2 brun cristallin, explosif et le chlorate Cu(ClO3)2.6H2O - liqueur verte qui donne des cristaux bleus, perchlorate, chlorate basique, etc. Mais il existe beaucoup de combinés de chlorures de cuivre et d'oxydes de cuivre :
- atéline : CuCl2.2CuO.H2O ;
- atacamite : CuCl2.3CuO.nH2O ;
- tallingite : CuCl2.4CuO.nH2O avec n = 6 ou 8 ;
- footéite : CuCl2.8CuO.12H2O ;
Il y en a sûrement d'autres.
5. Les composés avec le soufre
Ce sont des sulfuressulfures ou des sulfites ou des sulfates... le cuivre étant assez facilement attaqué par les acides (c'est le principe de la taille-douce par exemple).
Voici donc quelques réactions avec l'acide sulfuriqueacide sulfurique :
5 Cu + 4 H2SO4 -> CuS2 + 3 CuSO4 + 4 H2O et si la température augmente :
CuS2 + 2H2SO4 -> S + CuSO4 + SO2 + 2 H2O. L'équilibre est alors entièrement déplacé à droite par dégagement de gazgaz SO2.
Une réaction très célèbre est celle de la synthèse du méthane :
2H2S + CS2 + 8 Cu -> CH4 + 4CuS2 ici aussi dégagement de gaz.
*Il y a un gros chapitre avec les sels de soufresoufre : sels doubles de soufre et d'oxydes, complexes sulfurés, thiocyanates, etc...
6. Autres composés
Il y en a des milliers évidemment surtout avec le cuivre ! Avec les autres éléments des colonnes 5, 6 et 7 naturellement, des composés simples, binairesbinaires, voire ternaires, et une chimiechimie des complexes du cuivre qui serait un traité à elle toute seule. On ne parle pas de chimie organique ici non plus ! Et le but de ces dossiers n'est pas de donner une liste exhaustive des composés du cuivre.
On prendra deux exemples dont le premier est bien connu des étudiants : la liqueur de Fehling.
Premier exemple :
La réaction de Fehling est une réaction caractéristique des aldéhydesaldéhydes. Pour l'essentiel, la solution de Fehling (ou liqueur de Fehling) est un complexe basique d'ion cuivrique - Liqueur de Fehling A (liquideliquide bleu) - par les ions tartrate - Liqueur de Fehling B (liquide transparenttransparent) - à ne mélanger qu'au dernier moment car elle se dégrade assez vite.
La liqueur de Fehling contient, en milieu basique, des ions cuivre Cu2+ compléxés par les ions tartrate -O2C-CHOH-CHOH-CO2- (notés TT2-). La liqueur de Fehling renferme donc des ions complexes CuT22- de couleurcouleur bleu foncé limpide.
Au cours de la réaction, non stoechiométrique, le cuivre oxyde l'aldéhyde pour donner un acide selon la réaction bilan d'oxydo-réduction générale : R-CHO + 2Cu2+ (aq) + 5HO- (aq) -> RCOO- + Cu2O(s rouge) + 3H2O.
La liqueur de Fehling initialement bleue précipite en un dépôt de couleur rouge brique, à chaud, et cela uniquement en présence d'un sucresucre réducteur, pour ce qui concerne les sucres.
Second exemple :
Il répond à la question : « Quel est donc ce produit vert qui se forme sur les toitstoits en bronze ? » d'après un article paru dans le Bulletin de l'ICCICC ( Institut canadien de la Conservation), no 21, 1998 : Les bronzes de la colline du Parlement : Analyse des dépôts en surface. Lyndsie Selwyn, scientifique principale en conservation, Recherche sur les méthodes de restauration et les matériaux.
Dans le cas d'un chantier de rénovationrénovation des statues et toits au Québec un programme d'étude des altérations du bronze a été mis en place. Les 168 échantillons prélevés sur site ont été analysés, ce qui a permis l'identification de 94 composés cristallins et 9 matièresmatières organiques. Le tableau ci-dessous, tiré de l'article, comprend deux sections, soit « corrosioncorrosion superficielle » (le bronze réagit avec l'environnement local) et « contaminationcontamination superficielle » (matières étrangères).
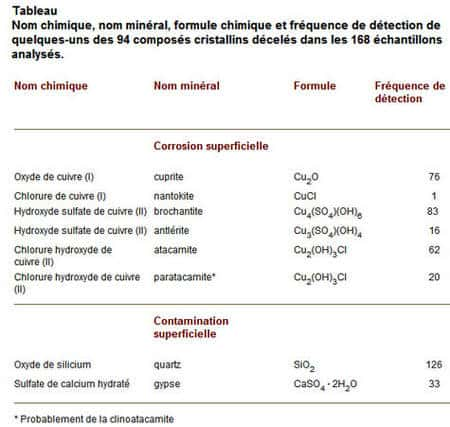
L'altération de la surface, après une exposition prolongée à l'extérieur, est constituée de composés de cuivre : d'abord une couche de composés de cuivre (I) ; après un certain temps, une deuxième couche apparaît de composés de cuivre (II) : hydroxydes, sulfates, chlorures, ce sont ces composés qui donnent la couleur verte ; ils contiennent du soufre et du chlorechlore, mais sont dépourvus de carbonates. Pourquoi ? Les concentrations élevées de soufre et de chlore dans l'environnement (urbain) favorisent la formation de sulfates plutôt que de carbonates. Le soufre vient des précipitationsprécipitations acides causées par les gaz polluants. La valeur du pH des précipitations, à Ottawa, se situait entre 4,2 et 4,4 entre 1979 et 1994. Les chlorures proviennent du sel des chaussées (hiverhiver). Un seul échantillon contenait de la nantokite, CuCl, associé à la « maladie du bronze ».
De nombreuses autres matières cristallines sont des contaminants. Le quartzquartz, le plus important, a été décelé dans 75 % des échantillons. Il y a aussi du gypsegypse. Le gypse est utilisé durant le moulage et il est impossible de l'enlever complètement. Légèrement soluble dans l'eau, une partie se dissoudra dans l'humidité à l'intérieur des statues creuses. Ces dépôts ont une couleur grise ou verte en raison des impuretés qu'ils renferment.
Il y avait encore plusieurs matières organiques : cires, huile siccative probablement appliquées autrefois comme revêtements protecteurs. Un oxalate de calciumcalcium et un oxalate de cuivre venant de l'acide oxalique sécrété par des micro-organismesmicro-organismes et les lichens présents en quantité dans la brumebrume et la pluie. Enfin, ont été trouvés de l'acide uriqueacide urique et son hydrate qui proviennent des fientesfientes d'oiseaux.
Pour se corroder, il faut un contact avec de l'eau qui contienne des sels en solution. Il importe de bien nettoyer la surface pour éliminer ces sels hydrosolubles durant les premières étapes du traitement de restauration.