au sommaire
Les réactions Redox sont aussi appelées réactions d'oxydoréductions. Le cuivre est un cas d'école pour étudier ce type de réaction chimique dans laquelle les atomes changent leur nombre d'oxydation. Voyons les piles : pile de Volta et pile de Daniell.

Le cuivre est, en effet, le cas d'école pour étudier ces réactions. Ce type de réaction est caractérisé par un transfert d'électronsélectrons entre un oxydant, capable de capter des électrons, et un réducteur, capable de céder des électrons. Ces derniers n'existent pas libres en solution aqueusesolution aqueuse, donc il faut que tout électron perdu par un réducteur soit capté par un oxydant. Les oxydants et les réducteurs peuvent être des atomes, des ionsions ou des moléculesmolécules. Les ions cuivre sont de très bons oxydants.

Par exemple, en plongeant une lame de zinczinc dans une solution de sulfate de cuivre CuSO4 un dépôt rouge de cuivre métallique pur se forme sur la lame de zinc. Les ions cuivre ont réagi : Cu + 2 e¯ -> Cu. En captant deux électrons, les ions cuivre jouent le rôle d'oxydant, ils subissent une réduction (gain d'électrons).
Le zinc métallique a lui été transformé en ions : Zn -> Zn + 2 e¯. En cédant deux électrons, Zn joue le rôle de réducteur et subit une oxydation (perte d'électrons). Ce sont des couples oxydant/réducteur. Chaque oxydant possède en effet son réducteur conjugué, il existe ainsi un nombre important de couples, répertoriés dans des tables. Voici, ci-dessous, quelques potentiels de réduction pour des équationséquations avec du cuivre :
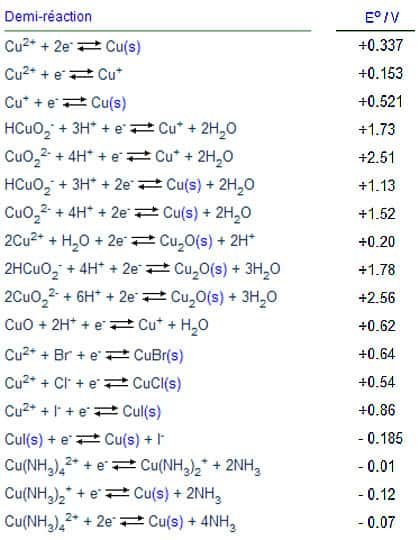
Les piles et générateurs
Une pile est un générateurgénérateur électrochimique qui doit son fonctionnement au transfert d'électrons d'un réducteur vers un oxydant, par l'intermédiaire d'un circuit électrique extérieur. La réaction d'oxydoréduction qui a lieu permet de stocker de l'énergieénergie sous forme chimique. Celle-ci est alors restituée sous forme d'un courant électriquecourant électrique. Alessandro VoltaAlessandro Volta est l'inventeur de la pile électrique.
Une pile est un générateur qui transforme de l'énergie chimique en énergie électrique. Une pile est constituée de deux compartiments séparés comportant chacun une électrodeélectrode, et d'une jonction (un pont salin ou une paroi poreuse) permettant de les relier tout en évitant le mélange des deux solutions.
Une demi-pile est formée d'une solution contenant un cationcation métallique dans laquelle est plongée une électrode solidesolide du métal. Le cation et l'électrode solide forment le couple oxydant/réducteur. L'électrode peut être constituée d'un matériaumatériau conducteur inerte comme le platineplatine ou le graphitegraphite.
Pile de Volta
Tout couple de métauxmétaux plongeant dans un liquideliquide ionique peut constituer une pile, par exemple une lame de cuivre et une lame de zinc piquées dans une pomme de terrepomme de terre ou un citron. On n'augmente pas la force-électromotrice en augmentant la surface des électrodes. Elle ne dépend que de la nature des métaux. Pour obtenir une tension plus forte, on doit placer plusieurs piles en série.

Biographie résumée de Alessandro Volta
Volta est né à Côme en 1745 d'une famille noble que la malchance et les malheurs ont appauvrie. En 1758, Volta entra au collège des Jésuites où ses poèmes étaient tellement bons que les Jésuites lui ont demandé d'entrer dans l'Ordre. Volta refusa.
Vers 1775, Volta commença ses premiers travaux sur l'électricité. Il mit au point l'électrophore qui permettait de multiplier des charges électriques et l'électroscope qui permettait de déceler les différences de potentiel qu'on désigna du terme VoltVolt en son honneur. Ensuite, il fut nommé professeur de physiquephysique expérimentale à l'École de Côme et en 1777, il effectuera des rencontres importantes Daniel Bernoulli et Albrecht Von Haller, par exemple.
En 1779, il est nommé à la chaire de physique de Pavie. Suite à ces travaux, en 1800, la première pile était née.
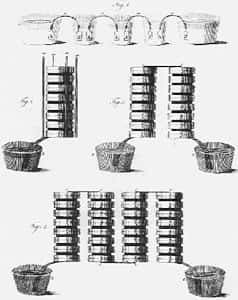
Bien sûr c'était « dans l'airair du temps » et d'autres chercheurs avant lui l'ont influencé : Luigi Galvani, professeur d'anatomieanatomie à l'Université de Bologne en est un. Les expériences de Galvani démontraient que les grenouilles avaient des contractions musculaires et que les contractions étaient optimales lorsque la grenouille était reliée par un fil de cuivre et un fil de zinc. Après maintes observations, Volta démontra que les convulsionsconvulsions de la grenouille étaient résultat d'une source de courant extérieur. Il émit donc l'hypothèse que l'électricité était générée par les deux plaques de métal. Ses plaques doivent alors être mises en contact avec un conducteur humide. Volta réalisa la première pile. Cette pile était composée de rondelles de métal différent, soit du zinc et du cuivre. Entre chaque superposition de rondelle, il y en avait une imbibée de saumuresaumure pour conduire le courant. Alessandro Volta intéressa le monde entier par la découverte de sa pile.
Ensuite, les premières batteries firent leur apparition. Elles étaient composées de plusieurs piles voltaïques réunies. En 1820, on découvrit que les phénomènes électriques étaient reliés aux phénomènes magnétiques : la boussole changeait de direction quand on la déplaçait autour d'un fil relié à la pile de Volta. En 1836, Daniell mit au point sa première pile...
Pile de Daniell
Elle est constituée de deux demi-piles. La première formée d'une solution de ions zinc et d'une électrode de zinc. La seconde d'une électrode de cuivre plongée dans une solution d'ions cuivre.
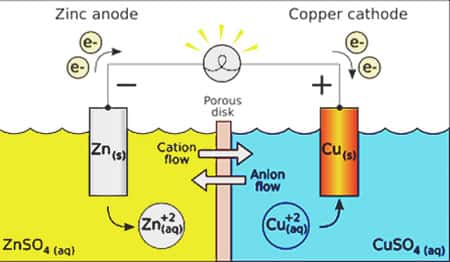
Une paroi poreuse sépare les deux solutions et les électrodes sont reliées par un fil conducteur. L'électrode de cuivre constitue le pôle positif et l'électrode de zinc le pôle négatif. Les électrons se déplacent dans le sens inverse du courant électrique.
Le pôle positif de la pile est toujours le siège d'une réduction. Les ions cuivre captent les électrons et se transforment en cuivre métal : Cu(aq) + 2 e¯ -> Cu(s). La solution perd sa couleurcouleur bleue caractéristique un dépôt de cuivre s'installe sur l'électrode. Le zinc cède des électrons au circuit : Zn(s) -> Zn(aq) + 2 e¯. L'électrode de zinc est consommée. L'équation globale d'oxydoréduction s'écrit donc : Cu(aq) + Zn(s) -> Cu(s) + Zn(aq).
Une pile fonctionne donc grâce à une anodeanode qui libère des électrons, une cathodecathode qui les reçoit et un électrolyte qui permet aux électrons de voyager entre les deux pôles. L'énergie chimique de la réaction d'oxydoréduction est transformée, grâce au transfert d'électrons, en énergie électrique. Tant que la pile débite, des électrons sont transférés du réducteur vers l'oxydant. Lorsque le quotient de réaction devient égal à K, constante d'équilibre, le système chimique est à l'équilibre et la pile ne débite plus. La pile est alors usée ou déchargée.
Une partie de l'énergie chimique est cédée au milieu extérieur par transfert thermique. C'est pourquoi une pile s'échauffe.
Petite biographie de John Frederic Daniell
PhysicienPhysicien et chimiste anglais né à Londres en 1790, mort dans cette même ville en 1845. Diplôme à l'Université d'Oxford. Daniell commence sa carrière dans une sucrerie puis quitte l'industrie pour un poste de professeur de physique à l'université d'Edinburgh à 23 ans. Vers 1817, il dirige la Continental Gas Company où il développe de nombreuses améliorations dans les techniques générales de fabrication du gazgaz. Il est, entre autres, l'inventeur d'un hygromètrehygromètre à condensationcondensation dit « à point de roséepoint de rosée » en 1820, et d'un pyromètre en 1830.
Il est nommé en 1831 Professeur de chimiechimie et météorologiemétéorologie au King's College de Londres où il enseignera jusqu'à sa mort. Il y rencontre Michael FaradayMichael Faraday qui recherche une source de courant plus performante que la pile de Volta. Il va mettre au point en 1836, une pile impolarisable à 2 liquides : « sa » pile.
Son prestige et ses qualités de chimiste lui vaudront d'être nommé, en 1841, vice-président de la Chemical Society of London. Il s'intéressera aussi à la météorologie. Il meurt à 55 ans d'une crise cardiaquecrise cardiaque lors d'un exposé devant la Royal Society.