au sommaire

La campagne du Téléthon c'est aujourd'hui vendredi et demain samedi...
Créée en 1958 pour financer des recherches sur les myopathies, des maladies génétiques rares et mal connues, l'AFMAFM a connu un immense succès populaire grâce à la télévision et au Téléthon, lancé en 1987. Depuis, le financement recueilli (budget de 102,3 millions sur 2008, dont 65 pour la recherche) draine de multiples programmes de recherche. Serge Braun, son directeur scientifique, nous explique le fonctionnement de l'association et les résultats déjà obtenus.
Futura-Sciences : Comment les dons du Téléthon parviennent-ils aux chercheurs ?
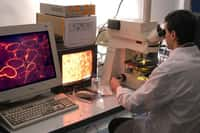
Serge Braun : Ils se transforment en effort de recherche notamment grâce à plusieurs « bras armés », le laboratoire Généthon, qui emploie 200 personnes, l'Institut de Myologie et l'Institut des cellules souches (I-Stem). En plus de cela, nous finançons des projets de recherches dans plusieurs centaines de laboratoires. Chaque année, nous recevons environ 600 demandes et nous en retenons à peu près la moitié, qui vont de petits budgets de financements jusqu'à des projets stratégiques à plusieurs millions d'euros.
FS : L'AFM s'occupe de maladies rares. Mais combien représentent-elles de malades ?
Serge Braun : On connaît 7.000 maladies rares (c'est-à-dire dont le taux de prévalence est inférieur à un cas sur 2.000 personnes). Elles touchent plusieurs millions de personnes en France, donc plus que les cancers. L'AFM finance les recherches sur 25 maladies, dont la moitié sont neuromusculaires.
FS : Les traitements découverts pour ces maladies rares sont-ils très spécifiques de ces pathologiespathologies et donc peu généralisables ?
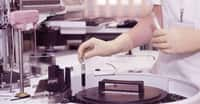
Serge Braun : Non, au contraire... On peut citer plusieurs exemples. Pour la maladie dite des bébés bulles, due à un déficit immunitairedéficit immunitaire génétique (appelé ADAADA-SCID), le traitement à l'essai, qui a déjà bénéficié à douze enfants, est une greffegreffe de cellules de moelle osseusemoelle osseuse après modification de leur génomegénome à l'aide d'un rétrovirusrétrovirus. On prélève chez le patient un petit nombre de cellules souches, celles qui donnent des globules blancsglobules blancs. Le gènegène déficient (qui code pour l'enzymeenzyme appelée ADA) est rectifié. Après mise en culture, ces cellules génétiquement réparées sont injectées par voie sanguine chez le patient et vont s'installer dans leur moelle osseuse. Voilà huit ans que les premiers essais ont été conduits et on observe que le système immunitairesystème immunitaire s'est reconstitué. Ces enfants sont tous sortis de leur bulle et mènent aujourd'hui une vie normale. L'ADA-SCID est très rare (1 cas sur 200.000 naissances) mais cette technique thérapeutique est applicable à d'autres maladies comme l'adénoleucodystrophie, une maladie rare, et la drépanocytosedrépanocytose, qui, elle, n'est pas rare.
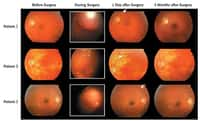
Dans une autre maladie, l'amaurose congénitale de Leber, une dégénérescence de la rétinerétine qui provoque une cécité avant 20 ans, la technique passe par l'injection sous la rétine d'un virusvirus modifié. Le gène responsable a en effet été détecté et le virus s'installe dans les cellules épithéliales, apportant le gène déficient. Les essais cliniquesessais cliniques démarreront en 2009. Cette technique est une avancée majeure et pourrait être intéressante pour deux affections de la rétine bien plus courantes, la cécité causée par un diabètediabète (due à une réduction de la vascularisation) et la dégénérescence maculairedégénérescence maculaire due à l'âge (causée au contraire par une vascularisation trop riche).

Serge Braun, directeur scientifique de l'AFM. © J.P. Pouteau
FS : Les recherches financées par l'AFM sont donc essentiellement tournées vers la génétique ?
Serge Braun : Les thérapies géniquesthérapies géniques représentent 40% des études menées et les thérapies cellulairesthérapies cellulaires environ 20%. Dans ce dernier cas, on pourrait aussi parler de technique génique, puisqu'il s'agit de cultiver des cellules, parfois de les modifier génétiquement et de les injecter chez un patient. Il reste 40% de traitements classiques, par médicaments pharmacologiques. A l'hôpital de la Timone, à Marseille, Nicolas Lévy a par exemple découvert un traitement contre la progéria, cette terrible maladie génétique qui accélère le vieillissement chez l'enfant. Après la découverte du gène responsable en 2003, ce médecin-chercheur a d'abord mis en évidence les phénomènes biochimiques qui conduisent à la maladie (une accumulation d'une protéineprotéine sous une forme toxique). Il a ensuite montré que la fonction enzymatiqueenzymatique déficiente pouvait être rétablie à l'aide de deux moléculesmolécules. Or, il s'agit de deux médicaments connus et couramment prescrits (contre l'ostéoporoseostéoporose et contre l'excès de cholestérolcholestérol). Les essais ont déjà commencé et cela va aller très vite. Comme dans bien d'autres cas, cette découverte pourra sans doute être utilisée dans d'autres pathologies et peut-être même contre le vieillissement, car un de ses mécanismes passe précisément par des mutations au cours du temps dans le gène de la progériaprogéria.
FS : Ces travaux peuvent-ils avoir des retombées scientifiques plus fondamentales ?
Serge Braun : C'est tout à fait possible. Les maladies rares constituent même de bons modèles. Lorsqu'un biologiste étudie l'effet d'un gène, il essaie d'obtenir une lignée d'organismes (bactériebactérie, plante ou animal) dont le gène à étudier ne fonctionne pas et observe les conséquences. L'étude de patients atteints de maladies génétiques permet, au fond, le même genre de travail. D'autre part, parce que les populations de malades sont faibles et les effets cliniques plus évidents à évaluer, les essais cliniques peuvent permettre des validations de traitements plus rapides.