au sommaire
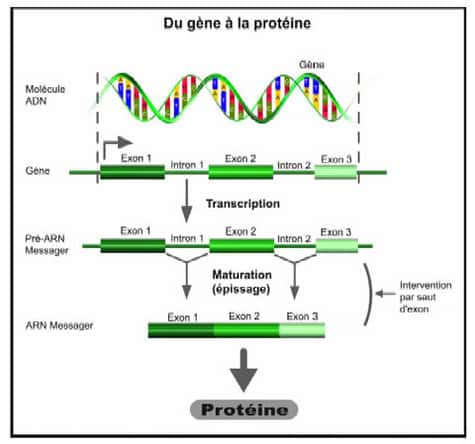
Le saut d'exon intervient durant la phase intermédiaire entre le gène et la protéine, au moment de l'épissage, et permet de rétablir la production d'une protéine tronquée mais fonctionnelle. Cette avancée illustre les progrès accomplis ces dix dernières années dans les techniques de thérapie génique, des techniques désormais très fines qui, en intervenant directement sur le message du gène, ouvrent de nouvelles perspectives thérapeutiques pour les maladies génétiquesmaladies génétiques.
© AFM/Dominique Hoarau
Ces travaux, réalisés par une équipe de Généthon dirigée par OlivierOlivier Danos et Luis Garcia (CNRS UMR 8115) en collaboration avec des chercheurs de l'Institut Cochin à Paris, sont publiés ce jour par la revue Science dans son édition en ligne Science Express.
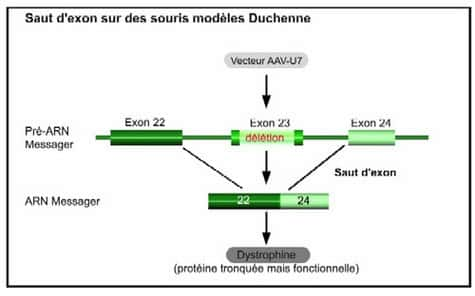
Au lieu d'apporter un gène-médicament au cœur de la cellule pour restaurer la protéine manquante, les chercheurs de Généthon ont choisi d'intervenir directement sur le message du gène pour en supprimer l'anomalieanomalie. Pour cela, ils ont utilisé la technique du saut d'exon qui intervient au moment de l'épissage. Pour produire une protéine donnée, le gène délivre à la cellule un code de fabrication. Ce code est notamment composé de « briques » appelés exons, qui doivent être assemblés bout à bout : c'est l'épissage. Dans le cas de maladies génétiques, le code est erroné car il y a une anomalie sur un ou plusieurs de ces exons.
Conséquence : la cellule n'arrive plus à fabriquer la protéine. Le saut d'exon a donc pour objectif de supprimer la partie du code comprenant l'erreur afin de rétablir le cadre de lecture et permettre à la cellule de fabriquer la protéine manquante.
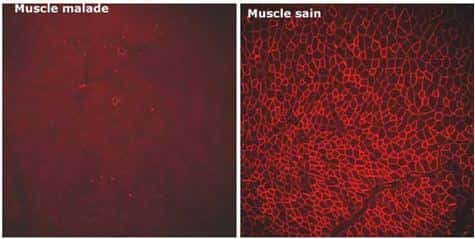
C'est l'objectif atteint par Luis Garcia et son équipe sur des souris modèles de la myopathie de Duchennemyopathie de Duchenne, la plus fréquente des maladies neuromusculaires. Cette maladie génétique à transmission récessive liée au chromosomechromosome X ne touche que les garçons. Le gène muté ne permet pas la production d'une protéine appelée dystrophine en raison notamment d'anomalies dans les exons qui perturbent (voire empêchent) la lecture. Grâce au saut d'exon,les chercheurs sont parvenus, chez la souris, à rétablir la production d'une dystrophine tronquée mais fonctionnelle.
© AFM/Dominique Hoarau
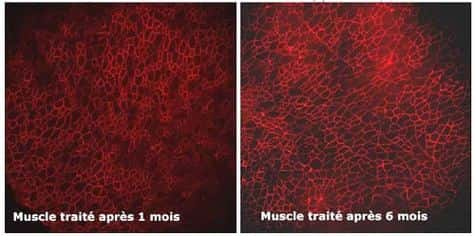
Pour ce faire, ils ont introduit dans la cellule, grâce à un vecteur AAVAAV (Adeno Associated VirusVirus), une moléculemolécule appropriée pour que l'épissage ignore l'exon défectueux (chez ces souris, il s'agit de l'exon 23). La molécule utilisée est un petit ARN (Acide RiboNucléiqueAcide RiboNucléique) du noyau cellulaire appelé U7, pouvant être modifié pour intervenir au moment de l'épissage. U7 va masquer l'exon défectueux et ainsi rétablir le cadre de lecture dans la cellule. Le couple AAV-U7 a été injecté dans le muscle d'une patte de souris adultes (âgées de 8 semaines) et, pour un second groupe de souris, par perfusionperfusion intra-artérielle. Dans les deux groupes, la dystrophine, absente des cellules musculairescellules musculaires, a été détectée à partir de 4 semaines après l'injection dans la plupart des fibres du muscle et les souris traitées ont montré des performances musculaires équivalentes aux souris saines. Depuis plus de six mois, le niveau d'expression de la dystrophine reste stable chez ces souris.
© Luis Garcia – Genethon 2004
Ces résultats, obtenus en intervenant directement sur le message du gène, ouvrent de nouvelles perspectives thérapeutiques pour les maladies génétiques. Ils illustrent l'évolution des techniques de thérapie génique qui viennent aujourd'hui apporter des réponses de plus en plus fines à chaque type d'anomalie génétique. Outre la myopathie de Duchenne, le saut d'exon concerne potentiellement toutes les maladies impliquant des protéines qui restent fonctionnelles même en cas de saut d'un ou de plusieurs exons au niveau de leur code de fabrication. Par exemple : l'hémophiliehémophilie (maladie du sang) ou la dystrophie musculairedystrophie musculaire congénitale (maladie neuromusculaire).
L'AFMAFM lance actuellement un programme visant à identifier toutes les maladies candidates à cette technique. De plus, la stratégie basée sur les petits ARNs du noyau cellulaire peut se révéler utile pour réparer l'épissage, dont le défaut est responsable d'environ 15% des maladies génétiques (notamment la thalassémiethalassémie ou la mucoviscidosemucoviscidose )).
© Luis Garcia – Genethon 2004
Ces résultats ont été obtenus, en moins de 2 ans, grâce à la structure intégrée mise en place à Généthon depuis 1999 : laboratoires de vectorologie pour la mise au point des vecteurs de thérapie génique, laboratoires d'imagerie, de cytologiecytologie et d'histologiehistologie pour l'évaluation in vivoin vivo des thérapeutiques... Généthon a acquis, en 14 ans, une expertise de premier plan sur le muscle et ses maladies. Il a su marier efficacement recherche fondamentale (en collaboration avec le CNRS) et développement préindustriel pour développer des thérapeutiques innovantes (thérapies génique et cellulaire). Aujourd'hui, le laboratoire de l'AFM prépare des essais cliniquesessais cliniques de thérapie génique pour des maladies neuromusculaires (myopathie de Duchenne, sarcoglycanopathie, calpaïnopathie) et du système immunitairesystème immunitaire (syndromesyndrome de Wiskott-Aldrich).
Ainsi, en ce qui concerne le saut d'exon, les chercheurs poursuivent aujourd'hui des études pré-cliniques afin de préparer un essai de phase 1 sur l'Homme d'ici 2007. Ils se concentreront dans un premier temps sur l'exon 51. En ciblant seulement 6 exons, cette technique pourrait concerner, chez l'Homme, 85% des délétionsdélétions du gène de la dystrophine (base de donnéesbase de données de JC Kaplan, Institut Cochin).