À l'état larvaire, les amphibiens sont capables de régénérer un membre perdu. Mais cette capacité disparaît à l'âge adulte. Des scientifiques ont réussi à régénérer la patte d'une grenouille adulte grâce à un cocktail de molécules.
au sommaire
Beaucoup d'amphibiensamphibiens sont capables de régénérer un membre perdu avant leur métamorphosemétamorphose ; une fois les animaux adultes, cette capacité décline fortement. Pour les scientifiques, comprendre les mécanismes biologiques derrière la régénération des membres est la première étape avant une éventuelle applicationapplication en médecine humaine. Des personnes amputées à la suite d'un accident ou les diabétiques, qui sont sujets à la nécrose des extrémités, pourraient alors voir leur membre tout simplement repousser. Aujourd'hui, cela tient plus de la science-fiction que de la réalité, mais les chercheurs travaillent activement sur ce sujet passionnant.
Le département de biologie de l'Université de Tufts, dans les environs de Boston aux États-Unis, a accueilli pendant plus d'un an une centaine de xénopes femelles adultes, des petites grenouilles fréquemment étudiées en biologie du développement. Les amphibiens ont testé un traitement unique en son genre. Un cocktail de cinq moléculesmolécules prises dans un hydrogelhydrogel qui a déclenché la régénération quasi parfaite de leur patte amputée. Les détails de cette expérience ont été publiés dans Science Advances.
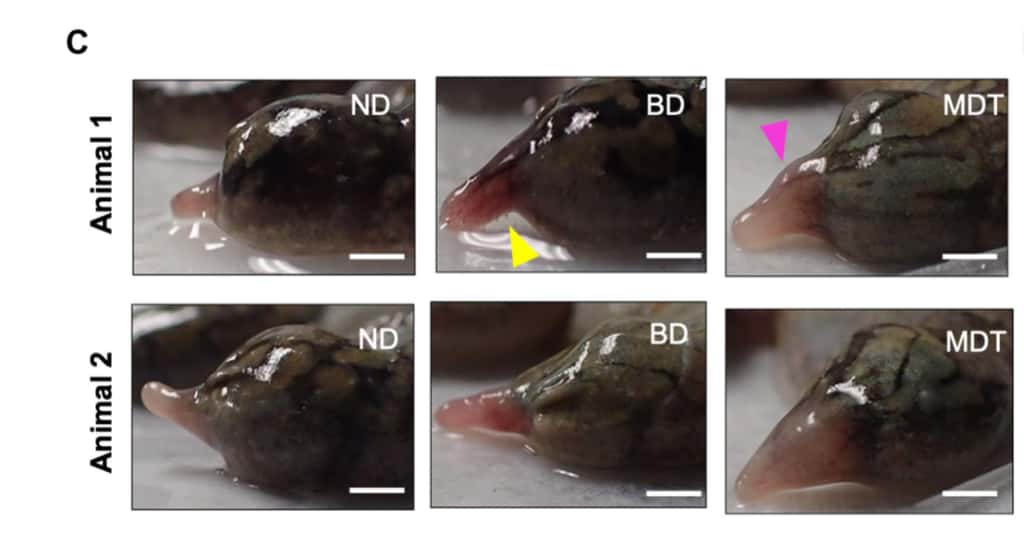
Une patte perdue, une patte retrouvée
Les animaux ont été amputés d'une de leurs pattes arrière sous anesthésie générale. Dans la foulée, les scientifiques ont appliqué au niveau de la cicatrice un hydrogel constitué de protéine de soie qui contient les cinq molécules régénératives : 1,4-DPCA, le facteur neurotrophique dérivé du cerveaucerveau (BDNF), l'hormonehormone de croissance, et la résolvine D5. Ces molécules participent à la croissance des vaisseaux sanguins, des nerfsnerfs et des tissus respectivement. La résolvine D5 est un anti-inflammatoireanti-inflammatoire. L'hydrogel reste en contact avec la plaie pendant 24 heures avant d'être retiré sous anesthésie. Les xénopes sont ainsi observés pendant 18 mois sans autre intervention.
Petit à petit, les scientifiques ont observé la régénération de la patte amputée chez les animaux soumis au traitement. Au bout de deux semaines seulement, les bénéfices du traitement apparaissent déjà. À partir de neuf mois, la régénération s'accélère jusqu'à la fin du suivi à 18 mois. En tout, 75 % des xénopes traités présentent un membre nouvellement formé à la structure aussi complexe que le membre natif, avec la présence de vaisseaux sanguins, de tissus osseux et de nerfs fonctionnels. Bien qu'atrophié, le membre régénéré semble fonctionnel et permet aux grenouilles de retrouver en partie leur mobilité.
Si le cocktail de molécules régénératives apparaît comme efficace chez les xénopes, rien n'est moins sûr chez les mammifèresmammifères, et encore moins chez les êtres humains. Actuellement, il est impossible de savoir s'il est possible de régénérer un membre de la taille de celui d'un humain avec cette technique. La première étape sera déjà de le tester sur des souris de laboratoire.
Médecine régénérative : une hormone aide à régénérer des membres sur une grenouille
Article de Marie-Céline RayMarie-Céline Ray, publié le 8 novembre 2018
Un nouveau pas a été franchi pour la médecine régénérativemédecine régénérative : des chercheurs américains ont régénéré en partie une patte de grenouille grâce à un « bioréacteur » qui délivre de la progestéroneprogestérone directement au niveau du membre amputé.
Pourra-t-on un jour faire repousser un bras ou une jambe ? Pour l'instant, cela reste de la science-fiction. Dans le monde animal, certains êtres vivants sont capables de régénération : des vers plats, les planaires, coupés en deux, reconstruisent un nouvel organisme ; des lézards font repousser leur queue et des crabes leur pince. Chez les mammifères, certains tissus, comme la peau, l'épithéliumépithélium intestinal, se régénèrent toute la vie, mais il est impossible de faire repousser un membre perdu par amputationamputation.
Avant de faire des essais chez l'homme, les chercheurs étudient des modèles animaux. Ici, des scientifiques de l'université Tufts ont travaillé sur un amphibien, le xénope (Xenopus laevisXenopus laevis)), une grenouille africaine souvent utilisée comme modèle en biologie. Dans cette espèceespèce, l'adulte a perdu les capacités de régénération qui existent chez le jeune. Après une amputation, cette grenouille régénère seulement un cartilagecartilage, sous la forme d'une sorte d'épine.
Pour cette étude décrite dans la revue Cell Reports, les chercheurs ont créé un bioréacteur portable qui libère de la progestérone localement. La progestérone est une hormone sexuelle féminine, mais elle possède aussi des capacités de régénération. D'après Celia Herrera-Rincon, principale auteure de l'article, la progestérone « module également la réponse immunitaireréponse immunitaire pour favoriser la guérisonguérison et déclenche la repousse des vaisseaux sanguins et des os. »

Un traitement de 24 heures déclenche une régénération sur plusieurs mois
Le dispositif mis au point par l'université comprenait une petite boîte avec un hydrogel contenant de la progestérone. Juste après l'amputation d'une patte arrière, le bioréacteur a été cousu sur le site de la blessure afin qu'il délivre de la progestérone pendant 24 heures, puis il a été retiré. Cette exposition de seulement 24 heures a eu un effet bénéfique et durable sur la repousse des tissus : les grenouilles régénéraient partiellement leur membre arrière, tandis que, sans traitement, les grenouilles ne régénéraient que des épines de cartilage.
Avec la progestérone, les grenouilles formaient une sorte de patte plate, comme une pagaie ou une raquette. Certes, la patte n'était pas parfaite et n'avait pas de pied, mais elle ne contenait pas que du cartilage : elle avait de l'os, des nerfs et des vaisseaux sanguins. Enfin, du point de vue fonctionnel, les animaux avec leur « patte plate » étaient plus actifs au niveau locomoteur que ceux qui n'avaient qu'une épine cartilagineuse.
L'exposition de 24 heures a suffi pour conduire à des changements pendant des mois dans l'expression des gènesgènes. Ce bref traitement a donc déclenché un programme de croissance et de remodelage tissulaire qui a favorisé un long processus de régénération. L'expérience a fonctionné sur une grenouille adulte, ce qui laisse présager des applications chez l'homme. L'idée est de trouver les molécules à appliquer pour réactiver un processus qui a déjà eu lieu dans la vie embryonnaire, comme l'a expliqué l'un des auteurs, Michael Levin, au New Scientist : « Votre corps sait comment fabriquer un membre - il l'a fait pendant le développement embryonnaire. »
Et si un jour, notre corps pouvait faire repousser un membre ?
Article de Jean-Luc GoudetJean-Luc Goudet paru le 2 juillet 2016
Pourquoi certains vertébrésvertébrés parviennent-ils à faire repousser une patte ou une nageoire amputée ? La question, sur laquelle les biologistes travaillent depuis longtemps, reste irrésolue mais des scientifiques viennent d'apporter un élément de réponse en découvrant les mêmes microARNmicroARN chez trois espèces très différentes. Or, ils existent aussi chez l'Homme où, qui plus est, ils fonctionnent de manière semblable.
Depuis longtemps, des biologistes explorent cette mystérieuse capacité de certains animaux à reconstruire un membre complet alors que tant d'autres, dont les mammifères, ne peuvent que bricoler un moignon. Pourtant, certains scientifiques pensent possible que cette fonction de régénération soit présente chez tous les vertébrés mais en quelque sorte désactivée.
C'est l'idée de départ de Benjamin King et Viravuth Yin, à l'université du Maine (États-Unis), qui postulent qu'un même mécanisme génétiquegénétique doit être à l'origine de cette capacité chez différentes espèces. Ils en ont choisi trois, deux poissonspoissons et un amphibien (le poisson-zèbre, le polyptère du Sénégal et l'axolotl), séparées par environ 420 millions d'années d'évolution. Bonne pioche, expliquent-ils dans un article publié dans la revue Plos One : ils ont effectivement trouvé un système génétique, basé sur dix microARN (petits ARNARN intervenant dans la régulation des gènes) et quatre ARNt (ARN de transfertARN de transfert servant à la lecture des gènes).
Cet ensemble est identique chez les trois espèces et semble fonctionner de la même manière. Les auteurs ont pu relier leur activité à des gènes actifs dans la formation des « blastèmesblastèmes », ces ensembles de cellules dédifférenciées qui apparaissent au niveau d'une lésion importante et qui vont se différencier de nouveau pour reformer les tissus ou le membre entier. CeriseCerise sur le gâteau : des séquences de ces ARNt existent chez l'espèce humaine.

Beaucoup de pistes de recherche, mais encore peu d'explications
Comme pour les autres études, ce coup de projecteurprojecteur n'éclaire par toute la scène et on est encore bien loin de comprendre cet étonnant pouvoir. Et encore plus loin de le réactiver chez l'humain... De précédentes recherches avaient pointé d'autres mécanismes. Globalement, l'idée tourne autour de la régulation de certains gènes, impliqués dans la régénération ou la formation de l'embryonembryon et dans la reprogrammation des cellules.
Chez le même poisson-zèbre (Danio rerioDanio rerio), en 2009, une équipe avait montré que des protéines, les histoneshistones, activaient des gènes au niveau d'un membre lésé pour déclencher la régénération des tissus. Sur ce plan, l'axolotl (Ambystoma mexicanum), proche des salamandres, vivant dans des lacs mexicains et célèbre pour passer sa vie à l'état larvaire (c'est la néoténienéoténie), est également renommé pour sa capacité de régénération.
En 2013, nous rapportions les travaux d'une équipe qui désignait les macrophages, des cellules de la réponse immunitaire, comme déclencheurs de ce phénomène. Un cousin, le triton à points rouges, réussit, lui, un petit exploit : des cellules de cœur installées dans le blastème formé après une amputation se transforment en cellules de pattes. La tentation est grande d'essayer d'en faire autant...