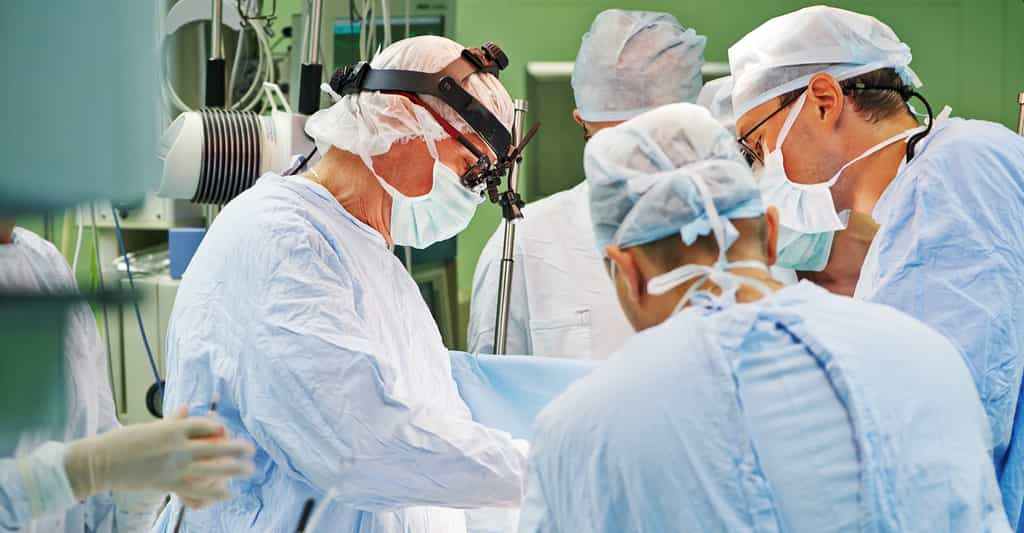
Une nouvelle technique de transfert de nerfs a permis à treize tétraplégiques de retrouver l’usage de leurs bras pour certaines actions. Elle a été associée aux transferts de tendons déjà utilisés dans ce même objectif.
au sommaire
« Ces résultats suggèrent que les transferts de nerfs peuvent aboutir aux mêmes améliorations fonctionnelles que les transferts de tendons traditionnels, avec des incisions moins grandes et de plus courtes périodes d'immobilisation après la chirurgie », selon les auteurs de cette étude australienne publiée, vendredi, dans la revue The Lancet.
L'étude a porté sur seize jeunes adultes, tétraplégiques, dont la moyenne d'âge était d'environ de 27 ans. Ils tous avaient subi, moins de 18 mois auparavant, une lésion de la moelle épinière pour la plupart, après un accident de voiturevoiture ou une blessure en faisant du sport, qui les avait laissés paralysés. L'opération a consisté à prélever des nerfs liés à des muscles toujours fonctionnels situés au-dessus de la blessure, et de les lier aux nerfs de muscles paralysés au-dessous de la blessure, afin de « ranimer » ces derniers.
Au total, l'équipe a procédé à 59 transferts de nerfs ayant pour but de restaurer chez ces patients l'extension du coude, ainsi que la capacité à faire un mouvementmouvement de pince avec la main et à saisir des objets. Chez dix des patients, des transferts de tendons ont été réalisés en plus des transferts de nerfs.

Objectif : restaurer les fonctions de la main et du coude
Deux ans plus tard, et après une rééducation intense, treize patients étaient capables de tendre leurs bras, d'ouvrir et fermer leurs mains et de manipuler des objets, pour se nourrir ou se brosser les dents. En revanche, sur trois patients, quatre transferts de nerfs réalisés n'ont pas réussi. D'autres recherches seront nécessaires avec davantage de patients, pour déterminer le type de personnes sur lesquels cette technique est la mieux à même de réussir, ont souligné les chercheurs. Enfin, deux autres patients n'ont pu être suivis après avoir été opérés et un dernier est décédé, sans lien avec l'opération.
“Pouvoir se servir de sa main est la priorité numéro 1, avant le fait de marcher”
« On connaît la technique du transfert de nerfs depuis longtemps, mais cela n'a jamais vraiment été utilisé pour les lésions de la moelle épinière auparavant, a expliqué à l'AFP Natasha van Zyl, chirurgiennne à Melbourne et auteure principale de l'étude. Le message à tous les patients au monde qui souffrent d'une lésion à la moelle épinière et à tous les soignants qui les traitent, c'est qu'il est possible de restaurer les fonctions de la main et du coude. Pour ces patients, pouvoir se servir de sa main est la priorité numéro 1, avant le fait de marcher ou de restaurer les fonctions sexuelles ».
Un bémol néanmoins, du côté d'un spécialiste qui n'a pas participé à l'étude, le Dr Mark Dallas de l'université de Reading (Angleterre), qui souligne toutefois que ce type d'intervention « ne restaure pas cette fonction au niveau où elle était avant la blessure ».
Bioélectronique : un implant biodégradable pour régénérer les nerfs
Article de Céline DeluzarcheCéline Deluzarche, publié le 15 octobre 2018
La repousse nerveuse peut être accélérée via la stimulation électrique. Des chercheurs ont inventé un implant à poser directement sur le nerf endommagé et pouvant être activé de l'extérieur pour un traitement en continu.
Accidents de voiture, de sport ou même, doigt coincé dans une porteporte : les lésions traumatiques des nerfs périphériques concernent des milliers de patients chaque année. Heureusement, contrairement aux fibres nerveusesfibres nerveuses du système nerveux centralsystème nerveux central dont l'atteinte entraîne une paralysie permanente, celles du système périphérique peuvent se régénérer et le contrôle actif du muscle peut être restauré. Néanmoins, cette reconstruction est très lente et reste souvent incomplète, menant à une perte de sensibilité et de motricité des membres touchés. Ces vingt dernières années, de nombreuses recherches ont été conduites visant à accélérer la repousse nerveuse, comme l'injection de facteurs de croissancefacteurs de croissance ou l'électrofilageélectrofilage. Parmi les pistes les plus efficaces, figure la stimulation électrique du nerf atteint. Mais cette technique n'est pour l'instant possible qu'au cours d'une intervention chirurgicale. « Une fois que l'opération est terminée, il n'y a plus de moyen d'agir », explique Wilson Zack Ray, neurobiologiste à l'université de Washington.
L’implant est enroulé autour du nerf endommagé et activé par induction magnétique. © Jingyue Cao (Kelly), Viméo
Un mini implant qui génère des impulsions électriques
Ce dernier vient peut-être de trouver une solution innovante pour résoudre ce problème. Avec ses collègues de l'école de médecine de l'université de Washington et de l'université de Northwestern (États-Unis), il a mis au point un implant électronique biodégradable qui génère des impulsions électriques régulières favorisant la régénération nerveuse et la reconstruction musculaire. L'implant, un petit disque de la taille d'un ongleongle et moins épais qu'une feuille de papier, s'enroule autour du nerf endommagé et disparaît entièrement en moins de deux semaines. Il est alimenté par un transmetteur extérieur, un peu comme les socles de chargement sans fil pour les téléphones portables.

L’implant se dissout entièrement en 25 jours en présence d’eau salée. © Matthew Macewan / Mike Worful
Les implants ont été testés chez des rats dont le nerf sciatiquesciatique était endommagé. Ils ont envoyé des impulsions électriques durant une heure à raison d'une, trois ou six fois par jour. Les neurobiologistes ont comparé les résultats avec des rats n'ayant bénéficié d'aucune stimulation. Résultat : plus les impulsions sont fréquentes et sont administrées sur une longue période, plus la reconstruction du nerf est rapide. Les rats stimulés retrouvent ainsi plus vite le signal nerveux et la force musculaire.
Un futur pacemaker biodégradable ?
D'après les chercheurs, dont les résultats ont été publiés le 8 octobre dernier dans la revue Nature Médecine, la bioélectronique pourrait un jour complètement remplacer les traitements médicamenteux pour de nombreuses pathologiespathologies. Un implant biodégradablebiodégradable pourrait, par exemple, être utilisé comme pacemaker temporaire ou servir de transmetteur entre la moelle épinière et d'autres sites d'influx nerveuxinflux nerveux. « En modifiant la composition et l'épaisseur de l'implant, nous pouvons programmer et doser la duréedurée et la fréquence des impulsions électriques, ainsi que sa durée de vie », assure John Rogers, professeur à l'université de Northwestern. L'équipe va d'ailleurs travailler sur des dispositifs dotés d'une longévité étendue à plusieurs semaines. Reste à confirmer ces résultats chez l'humain, mais Wilson Zack Ray est plutôt confiant : « C'est une toute nouvelle approche pour un problème qui n'avait jusqu'ici aucune solution clinique », assure-t-il.
Ce qu’il faut
retenir
- Une nouvelle technique a permis à des tétraplégiques d'utiliser leurs bras pour certains actes comme tendre un bras, ouvrir et fermer la main.
- Elle consiste en un transfert de nerfs qui peut être associée au transfert de tendons.
- La technique a été concluante, au bout de deux ans et après rééducation, sur 13 des 16 jeunes paralysés après un accident ou un exercice sport.
- Les chirurgiens et auteurs de l'étude estiment qu’il est possible de restaurer les fonctions de la main et du coude.