au sommaire
« Jusqu'à maintenant, c'était comme par magie que l'amputation était traduite par l'activation des gènes, explique Scott Stewart du Salk Institute for Biological Studies. Nous avons enfin une piste pour suivre ce processus. » Lui et son équipe viennent en effet de comprendre comment, chez le poisson zèbrepoisson zèbre, Danio rerio, la régénération d'un membre perdu provoque la réactivationréactivation de gènes inactifs depuis le développement embryonnaire. C'est la déméthylation des histones qui réveille les cellules au niveau de l'amputation et active les gènes responsables de la formation du nouveau membre.
Comme la régénération reprend les mécanismes du développement embryonnaire, les chercheurs ont commencé par chercher les similarités entre ces deux processus. Au cours du développement de l'embryon, des gènes spécifiques sont activés et désactivés pour déclencher les conditions nécessaires à la création d'un organisme entier. Leurs tâches accomplies, ces gènes redeviennent silencieux.
Scott Stewart a fait l'hypothèse que les deux mécanismes pourraient partager les mêmes processus d'activation et désactivation. Dans les cellules souches embryonnaires, des protéinesprotéines d'histone, responsables de l'empaquetage de l'ADNADN et pouvant être transformées chimiquement par méthylationméthylation ou acétylationacétylation, maintiennent les gènes en stand by. Ces méthylations et acétylations peuvent être considérées comme des interrupteurs, des marqueurs d'activation et de désactivation de certains gènes.
Ce biologiste a ainsi découvert les mêmes modifications des histones sur les cellules embryonnaires et en stand by et sur celles impliquées dans la régénération. Selon lui, « cela suggère que deux différents programmes d'expression des gènes pourraient exister ; un pour l'activité cellulaire normale et un pour la régénération ».
Kdm6b.1, l’enzyme clef

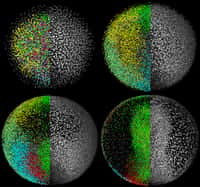
En haut : le traitement de l’amputation par des inhibiteurs de méthylation empêche la régénération. En bas : Nageoire caudale complètement régénérée au bout de sept jours sans traitement. © Scott Stewart/Salk Institute for Biological Studies
Pour tester cette hypothèse, Scott Stewart et Juan Carlos Izpisua Belmonte ont observé l'état des histones lors de la régénération. Comme ils s'y attendaient, le nombre de marqueurs d'activations a augmenté tandis que ceux de désactivations diminuaient lors d'une régénération. Mieux encore, ils ont observé une forte concentration d'enzymesenzymes déméthylases dans les tissus en régénération et surtout, ils ont identifié une enzyme présente uniquement dans ces tissus, la Kdm6b.1. Sans celle-ci, le poisson zèbre est incapable de se régénérer.
Dans l'immédiat, les chercheurs vont poursuivre leurs études pour déterminer l'ensemble des cibles de l'enzyme Kdm6b.1 ainsi que par quel mécanisme les gènes sont désactivés une fois que le membre est entièrement régénéré. A plus long terme, ils espèrent comprendre dans quelle mesure ils pourraient provoquer ce mécanisme chez des mammifèresmammifères. Mais avant d'envisager de faire repousser un bras humain, il faut s'assurer de pouvoir stopper la régénération, sous peine de résultats monstrueux. D'où l'importance de comprendre le mécanisme de désactivation des gènes.