au sommaire
L'atmosphère : un réacteur photochimique
Contrairement aux atmosphèresatmosphères internes des planètes géantes gazeusesplanètes géantes gazeuses comme JupiterJupiter, l'atmosphère de la Terre n'est pas en équilibre thermodynamique. L'essentiel de l'énergie de la Terre provenant du rayonnement solairerayonnement solaire, celui-ci est à l'origine d'un déséquilibre que les forces de la Nature tentent de corriger en permanence, soit en stockant cette énergie comme par exemple la photosynthèsephotosynthèse et le stockage du carbone (l'ensemble de l'énergie stockée sur Terre par les énergies fossilesénergies fossiles ne représente que ~ 25 jours d'ensoleillement !)), soit en l'évacuant par rayonnement infrarouge après l'avoir redistribuée par les phénomènes météorologiques (courant marins, ventsvents, pluies, neige, etc) et la circulation océanique. C'est cet équilibre entre énergie reçue, redistribuée et évacuée qui maintient la surface de la Terre à une température moyenne de 15 °C mais qui génère aussi un état chimique de l'atmosphère fortement dynamique.
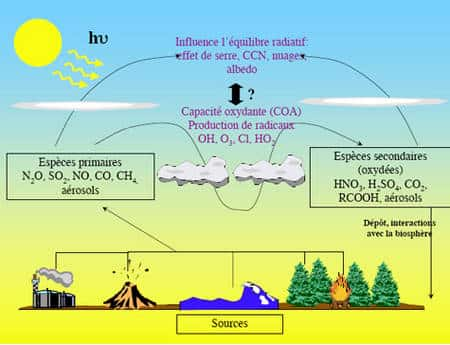
D'un point de vue chimique, l'atmosphère peut être considérée comme un réacteur chimique oxydant. Bien sûr la présence de 21 % en volume d'oxygèneoxygène moléculaire n'y est pas pour rien mais O2 est loin de constituer l'espèce chimiqueespèce chimique la plus oxydante de l'atmosphère. Si tel était le cas, notre atmosphère ne contiendrait certainement pas autant d'oxygène moléculaire. En effet, réactivité et concentration dans l'atmosphère sont généralement étroitement liées, ce qui se comprend facilement : plus une moléculemolécule est stable, plus elle a de chance de s'accumuler dans l'atmosphère et vice versa. Le dioxygène bien que facilitant la combustioncombustion n'engendre que très rarement des combustions spontanées. C'est à travers la loupe des espèces à très faible concentration qu'il faut regarder l'atmosphère pour comprendre sa réactivité chimique. La figure 5 schématise grossièrement ce fonctionnement. Essentiellement au niveau du sol se trouvent des sources émettrices de composés primaires.

Figure 5 : Fonctionnement schématique du réacteur chimique atmosphérique © J. Savarino
Elles sont aujourd'hui aussi bien naturelles que d'origine humaine. Leur particularité est d'émettre majoritairement des composés peu ou faiblement oxydées pour des raisons thermodynamiques (effet de température, milieu anaérobique, combustion non contrôlée, etc). Ces composés chimiques vont alors subir des attaques oxydantes car elles sont en situation d'instabilité par rapport au potentiel d'oxydationoxydation de l'atmosphère, mais non directement par O2 mais par des radicaux libresradicaux libres (OH, HO2, Cl) et des molécules oxydantes comme l'ozoneozone qui se trouvent en concentration d'ultra trace (de l'ordre d'une espèce oxydante pour un milliard de molécule, voire beaucoup moins pour les radicaux les plus réactifsréactifs).

Figure 6 : Une fine pellicule, qui paraît bien fragile face à l’immensité du vide, voilà à quoi ressemble l’atmosphère terrestre vue depuis l’espace © NASA
Ces dernières sont directement issues de la brisure de molécules simples par le puissant rayonnement solaire. Par suite d'une succession de réaction en chaîneréaction en chaîne impliquant les oxydes d'azoteoxydes d'azote, les peroxydes et d'autres intermédiaires, l'atmosphère se trouve chargée d'espèces au fort pouvoir oxydant dont l'ozone est le plus abondant. Sa propre destruction par le rayonnement ultra violet (UVUV) du soleilsoleil conduit à la formation du « détergent » de l'atmosphère, le radical libre OH. Ce radical extrêmement réactif attaque la majorité des espèces primaires et les oxyde en espèces secondaires, généralement des composés comme les aérosolsaérosols d'acides sulfuriquesacides sulfuriques (H2SO4) ou nitriques (HNO3) qui sont rapidement éliminés de l'atmosphère par les pluies ou la sédimentationsédimentation. Ils seront par la suite réutilisés par la matièrematière vivante comme source d'énergie, bouclant ainsi le cycle biogéochimique. Avant d'être transformés ou éliminés, les espèces primaires et secondaires interagissent avec le bilan énergétique de l'atmosphère en réfléchissant (aérosols) ou emprisonnant (gaz à effet de serregaz à effet de serre) l'énergie solaire incidente et ont donc une action importante sur le climatclimat. On voit donc se construire un système hautement couplé où climat, chimiechimie atmosphérique et cycles biogéochimiques sont en interaction permanente autour d'un équilibre précaire, entretenu par la photochimie. Dans ce schéma de fonctionnement, l'ozone occupe une place centrale et privilégiée puisqu'elle joue à la fois le rôle d'un oxydant puissant, de source de radicaux libres OH mais aussi de gaz à effet de serre. Elle est la clef de voûte du réacteur chimique atmosphérique et conditionne son état. Pas étonnant qu'elle soit un des objets les plus étudiés de l'atmosphère.