au sommaire

Les événements "zéro ozone"
L'observation de l'atmosphèreatmosphère nous le rappelle constamment : notre connaissance du fonctionnement du milieu naturel est loin d'être parfaite. Alors qu'une partie des chimistes de l'atmosphère s'attelaient à la compréhension de l'ozone stratosphérique ou du smogsmog photochimique, d'autres se penchaient sur un phénomène nouveau : l'Arctic haze (brumebrume ArctiqueArctique).
Ce phénomène de pollution se caractérise par l'apparition dans le bassin Arctique d'une atmosphère fortement chargée en aérosolsaérosols acides et autres polluants incluants des métauxmétaux lourds, dans une région du monde dépourvue de sources de pollution et très faiblement habitée. De plus, contrairement au smog photochimique des grandes agglomérations qui se développe en été sous un puissant rayonnement, la pollution ici se produit en hiverhiver, sous faible ensoleillement.

Figure 10 : Dépigmentation de la végétation Arctique causée par l’agression d’une atmosphère fortement chargée en composés acides © : Dan Aamlid
Une fois encore, c'est d'abord l'observation des dégâts infligés aux écosystèmesécosystèmes qui a attiré l'attention des scientifiques et des décideurs (Figure 10)). L'attaque incessante des forêts boréalesforêts boréales et des écosystèmes Arctique par des pluies acides conduisait à des dépérissements à grande échelle (Figure 11).

Figure 11 : Forêt boréale endommagée par les pluies acides © : US Forest Service
Pour comprendre ce phénomène, des stations d'observation de l'atmosphère furent installées sur le pourtour Arctique durant les années 70 et 80. Dans les années qui suivirent, les processus à l'origine de l'Arctic haze furent identifiés. Les polluants émis par les régions industrialisées de l'hémisphère Nordhémisphère Nord (Europe, Russie, Etats-Unis et aujourd'hui Asie), plus importants en hiver (industrie métallurgique, chauffage domestique, transport), sont transportés sur de grandes distances par la circulation atmosphériquecirculation atmosphérique et injectés dans l'atmosphère Arctique. En chemin ils sont convertis en acide sulfurique, nitrique et autres produits corrosifs.
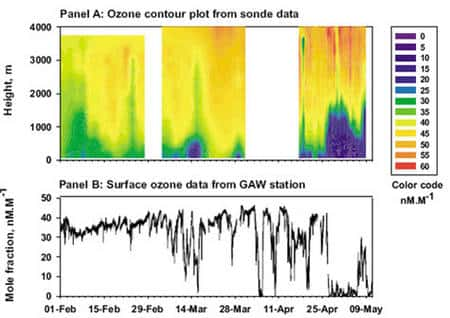
Figure 12 : Evénements de destruction total de l’ozone au niveau de la mer à la station canadienne d’Alert (Arctique canadien) © J. Bottenheim
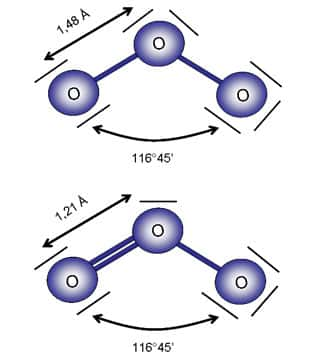
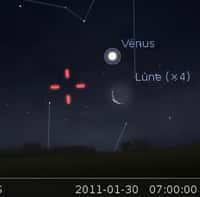
Mais au détour de ces études, une observation attira plus particulièrement les scientifiques canadiens. Au levé du soleil Arctique, vers Mars - Avril, subitement les concentrations d'ozone atteignaient des valeurs plancherplancher, plus basse que la limite de détection des instruments, et ce pour une durée pouvant aller de quelques heures à une semaine (Figure 12). Cette observation fût étonnante car on pensait que l'atmosphère, même naturelle, contenait en permanence les éléments nécessaires au maintien d'une concentration d'ozone mesurable (mélange d'oxydes d'azoteoxydes d'azote et de composés organique volatils). Une avancée majeure se produisit lorsque que l'on observa une corrélation entre les chutes de concentration d'O3 et la teneur élevée en bromebrome (Br) dans l'atmosphère. Or les études sur la destruction de l'ozone stratosphérique, le fameux « trou » d'ozone, montraient le rôle prépondérant joué par l'activation du chlorechlore (Cl) dans la destruction catalytique de l'ozone.
Le chlore et le brome appartiennent à la même famille d'élément, appelée les halogèneshalogènes, et partagent de fait des propriétés similaires. Sous forme atomique, les deux éléments se révèlent être de puissants destructeurs d'ozone mais pas dans les mêmes compartiments de l'atmosphère. Alors que le chlore est très actif dans la destruction de l'ozone stratosphérique, il l'est beaucoup moins dans la troposphèretroposphère car il réagit plus rapidement avec les espècesespèces organiques, très présentes dans les basses couches de l'atmosphère, qu'avec l'ozone. En revanche le brome est moins réactifréactif avec les organiques et son potentiel de destruction de l'ozone troposphériqueozone troposphérique est de fait décuplé, environ 40 fois supérieur à celui du chlore.
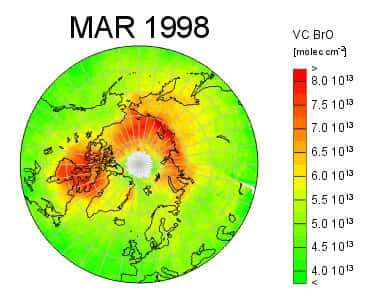
Figure 13 : Photo satellite montrant l’explosion des oxydes de brome responsable de la destruction de l’ozone au niveau du sol dans l’arctique : l’explosion de brome © A. Richter
Il est apparu dès lors évident que les évènements de destruction d'ozone au niveau du sol dans l'Arctique avaient pour origine l'activation de quantités importantes de brome au printemps, aujourd'hui connue sous le terme d'explosion de brome (Figure 13) et que ce brome ne pouvait venir que de l'eau de mer, seul réservoir important de cet élément se trouvant à proximité. Reste à expliquer comment le bromure de l'eau de mer qui est un sel inactif vis-à-vis de l'ozone s'active en brome gazeux. Or, force est de constater qu'aujourd'hui encore cette question est débattue dans la communauté et qu'aucune réponse satisfaisante, respectant toutes les contraintes observationnelles n'a été apportée.

Figure 14 : Glace de mer en formation sur les rivages du Spitzberg (78° N). Ce processus est probablement à l’origine d’émissions importantes de brome, lequel détruit entièrement l’ozone des basses couche de l’atmosphère Arctique) © : J. Savarino
Néanmoins, un faisceau d'indice pointe en direction de la glace de mer (Figure 14) qui, lorsqu'elle se forme rejette les impuretés vers les poches de liquidesliquides restantes produisant une augmentation très importante de la teneur en sel de mer. Ce phénomène de concentration associé à d'autres processus serait à l'origine d'une réaction catalytique de libération de brome gazeux.