au sommaire
Découverte, structure, propriété et usage
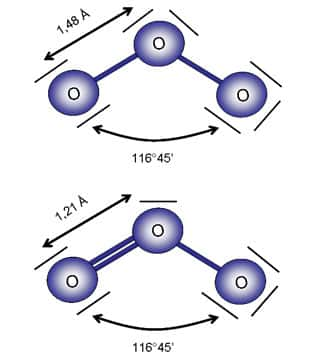
L'ozone (O3)) est un allotropeallotrope de l'oxygène tout comme le diamant et le graphite sont des allotropes du carbone. Elle est formée par l'association de trois atomesatomes d'oxygène et se présente sous la forme d'un triangle isocèle d'angle au sommet de 116°45' et de deux liaisons interatomiques de 1,278 10-10 m. Sa structure chimique peut être représentée par un hydride de résonancerésonance de deux états métastablesmétastables (en faite 4 par effet de symétrie) où chaque liaison chimiqueliaison chimique est une alternance entre une simple et double liaison covalenteliaison covalente, justifiée par une distance interatomiques comprise entre ces deux extrêmes. Cette structure confère à cette moléculemolécule un caractère métastable dans les conditions ambiantes. L'ozone a une tendance naturelle à se décomposer en dioxygène (O2) et oxygène atomique (O) ou à réagir avec d'autres composés. Cette capacité à céder facilement un atome d'oxygène lui confère un très fort pouvoir oxydant, juste après le fluorfluor (F2). A température ambiante, c'est un gazgaz qui prend une coloration bleue pâle à forte concentration. Il se liquéfie en un liquideliquide bleu foncé à -111,9 °C et se solidifie à -192,5 °C.

Figure 1 : Structure moléculaire de l’ozone montrant les deux formes résonantes
Les premières découvertes de l'ozone se sont produites au moyen des plus simples méthodes d'observation : les sensations directes. Une forte odeur caractéristique a été associée rapidement, dès 1775, au fonctionnement des machines électriques sans l'associer à la présence d'une substance chimique. Il faut attendre 1839 et les expériences de Christian Schönbein sur l'électrolyseélectrolyse de l'eau pour que celui-ci, remarquant une odeur similaire propose l'existence d'un gaz qu'il nommera ozone du Grecque ozien « qui sent ». Après cette découverte l'intérêt pour l'ozone grandit rapidement.

Figure 2 : Le chimiste Allemand Christian Schönbein, découvreur de l’ozone en 1839.
On découvre rapidement ses propriétés oxydantes et de décoloration de la matièrematière organique, d'élimination des odeurs nauséabondes, de dégradation du caoutchouccaoutchouc. Les effets sur la santé humaine sont aussi très vite répertoriés ; l'ozone causant des chocs respiratoires, l'inflammationinflammation des muqueusesmuqueuses et dans le cas d'expérimentations animales à forte concentration, la mort. Des méthodes par réaction chimiqueréaction chimique spécifique sont développées pour le détecter dans l'airair.

Figure 3 : Formation d’ozone par décharge électrique et condensation du gaz sous forme d’un liquide bleu par refroidissement à l’azote liquide © J. Savarino
Durant le demi-siècle suivant, l'ozone est étudiée sous toutes ses coutures. On cherche à comprendre sa composition chimique, déterminée comme l'association de trois atomes d'oxygène dès 1865, ses relations potentielles avec des maladies comme le choléracholéra ou la grippegrippe, ses applicationsapplications possibles comme désinfectant et sa présence dans l'atmosphèreatmosphère. La découverte de ses propriétés bactéricides propulse la production d'ozone à l'échelle industrielle.
L'ozone est massivement produite non plus par électrolyse, trop peu efficace mais par décharge électrique d'oxygène moléculaire. Les premières usines d'ozonation de l'eau apparaissent. On compta jusqu'à 49 installations de traitement de l'eau par l'ozone dont 26 en France au soir de la première guerre mondiale ! Les travaux sur les gaz toxiques et notamment sur le chlorechlore freineront leur développement. Bien que possédant un pouvoir désinfectant et oxydant plus faible (ce qui explique pourquoi le chlore est oxydé par l'ozone et non le contraire, voir l'ozone stratosphérique), la stabilité et les bas coûts de production du chlore en ont fait jusqu'à nos jours le produit désinfectant le plus utilisé.
Notons tout de même un retour en force de l'ozone sur le marché de la désinfection de l'eau (plus de 2000 installations vers la fin des années 80), principalement parce qu'il ne laisse aucune trace dans l'environnement et ne produit pas de sous-produits toxiques contrairement à la désinfection par le chlore. L'utilisation de l'ozone est poussée jusqu'à être introduit dans certains systèmes d'air conditionnéair conditionné pour le traitement des odeurs et la désinfection des conduits d'aération. Dans l'industrie pétrochimique, très tôt les propriétés de craquage de la matière organique par rupture des doubles liaisons C=C par ozonolyse ont été mises à contribution. Au début du vingtième siècle, les générateursgénérateurs d'ozone et l'ozonolyse sont couramment utilisés dans les laboratoires de chimiechimie organique, permettant aux chimistes de casser les grandes molécules organiques et d'en comprendre leur structure. La similitude entre le craquage du caoutchouc induite par l'ozone et l'ozonolyse des molécules organiques, sera un élément déterminant dans la reconnaissance et l'identification de l'ozone comme polluant atmosphérique. L'ozone est aussi utilisé pour le blanchiment du linge ou de la pâte à papier, pour l'élimination des traces de matière organique dans la microélectronique ou le lavage des aliments à l'eau ozonisée dans l'industrie alimentaire.
Schönbein fut le premier à proposer une méthode quantitative de mesure de la concentration d'ozone basée sur des bandelttes de KI exposées à une atmosphère ozonisée. Dès sa découverte dans l'atmosphère, ces techniques chimiques pour mesurer l'ozone se développent et s'affinent. Autour des années 1850, on estime qu'elle est mesurée dans l'atmosphère de plus de 300 villes, totalisant plus d'un million de mesures individuelles qui malheureusement seront pour la plus part inexploitables par absence de calibration, de présence d'interférencesinterférences chimiques ou de biais météorologiques.
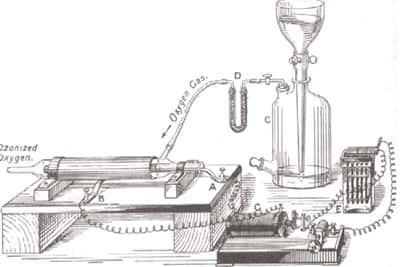
Figure 4 : Générateur d’ozone de Siemens - 1858
Toutefois, le travail remarquable et méticuleux d'Albert Lévy au parc Montsouris de 1876 à 1910 permettra aux chimistes de l'atmosphère de disposer du plus ancien enregistrement d'ozone atmosphérique à une époque où l'industrialisation et la consommation d'énergie fossileénergie fossile n'étaient qu'à ses balbutiements, permettant ainsi de fixer le niveau de bruit de fond urbain. Au début du vingtième siècle, l'intérêt de la mesure de l'ozone atmosphérique se perd rapidement, résultant probablement de l'échec à établir une quelconque relation entre l'ozone et les maladies. Il faudra la persévérance d'un petit groupe de scientifique plus intéressé par la météorologiemétéorologie et la structure de l'atmosphère que les effets sur la santé pour révéler l'importance de l'ozone pour l'équilibre physico-chimique de l'atmosphère et son influence sur le développement de la vie à la surface de la Terre.