au sommaire
Une exception isotopique
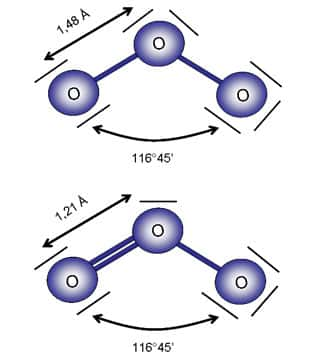
Comme nous l'avons vu en début de dossier, l'ozone est constitué de 3 atomes d'oxygène. Or, l'oxygène possède trois isotopes stables, le plus abondant étant l'isotope 16, noté 16O (99.8 %)), composé de 8 protons et 8 neutronsneutrons, puis l'isotope 18O (0.2 %), 8 protons et 10 neutrons et enfin l'isotope 17O (0.03 %), 8 protons et 9 neutrons. L'ajout de neutron ne modifie pas la nature de l'élément car il influence très peu les propriétés intrinsèques de l'atome. Tous les isotopes stables de l'oxygène se comportent donc de la même façon. Compte tenu des abondances naturelles des isotopes de l'oxygène, dans la nature seules trois formes d'ozone dominent : 16O16O16O, 16O16O17O, 16O16O18O.
Depuis la mise en place des lois fondamentales qui gouvernent la répartition des isotopes dans la matièrematière dans les années cinquante, nous savions que les proportions relatives des 3 isotopes stables de l'oxygène se devaient de suivre des lois dépendant de la massemasse. C'est ainsi que toute variation du rapport 18O/16O dans un matériaumatériau entraînait une variation de moitié du rapport 17O/16O. Ce facteur ½ s'explique assez facilement. Puisque que la grande majorité des processus physiquesphysiques, chimiques et biologiques dépend de la masse (vitessevitesse de réaction, transport, assimilation biologique, diffusiondiffusion, etc) et que les différences de masse entre les rapports isotopiques sont de 18O - 16O = 2 unités de masse atomique et 17O - 16O = 1 unité de masse atomique, leur rapport conduit naturellement au facteur ½. En d'autres termes, si la composition isotopique d'un matériau oxygéné varie de x pour le rapport 18O/16O alors il variera de x/2 pour 17O/16O. Cette loi est vérifiée pour tous les réservoirs d'oxygène de la Terre que sont l'oxygène de l'airair O2, les silicatessilicates et autres minérauxminéraux, le CO2 etc. Mais une fois de plus, l'ozone joue les troubles fêtes.

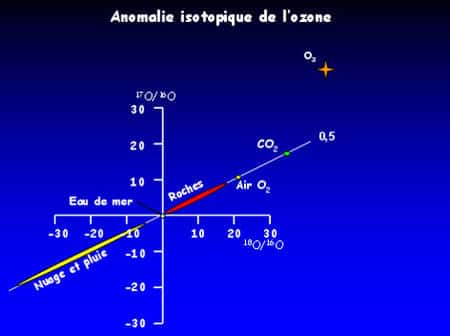
Figure 15 : L’ozone possède une composition isotopique unique et bien différente du reste des matériaux terrestres.
Pour des raisons encore mystérieuses, alors que ce rapport vaut ½ pour tous les matériaux terrestres à quelques exceptions près, il vaut 1 pour l'ozone (Figure 15). Les exceptions sont des espècesespèces atmosphériques produites par attaque oxydante de l'ozone qui leur transfère son anomalieanomalie isotopique. Ils héritent donc de cette spécificité via l'ozone. Cette particularité de l'ozone est aujourd'hui mise à profit pour sonder l'activité oxydante de l'ozone atmosphérique. La composition isotopique de l'oxygène sur des espèces atmosphériques porteporte les cicatricescicatrices des agressions oxydantes de l'ozone.