Des chercheurs des universités de Toronto et McMaster viennent d'obtenir des résultats prometteurs en testant un nouveau traitement contre le glioblastome, une forme prévalente et agressive du cancer du cerveau.
au sommaire
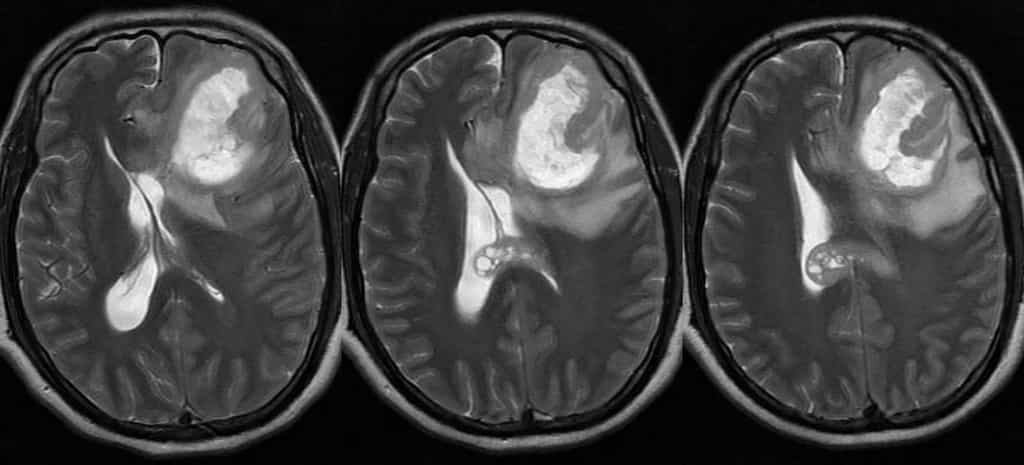
Le glioblastome multiforme (GBM) est la tumeur du cerveau la plus fréquente chez l'adulte. C'est aussi la plus agressive. Bien que la chimiothérapie, la radiothérapie et la chirurgie puissent être employées pour ralentir sa progression, à ce jour, ces mesures n'ont de valeur que palliative. En effet, la majeure partie des malades ont une espérance de vie de moins d'un an, et seulement 3 % d'entre eux parviennent à atteindre la marque des 5 ans. Chaque année, plus de 241.000 personnes meurent de cette terrible maladie.
Les lymphocytes T en action
Les lymphocyteslymphocytes TT jouent un rôle capital dans la réponse immunitaireréponse immunitaire. Présents dans le sang, ils sont capables de cibler et de détruire les cellules infectées par un virusvirus ou une tumeurtumeur. Ces cellules malades présentent en effet des antigènesantigènes mutés, distincts de ceux produits par « le soi ». Un autre type de cellule immunitaire (la cellule présentatrice de l'antigène, ou CPA) « met en garde » le lymphocite T contre ces intrus via une structure appelée complexe majeur d'histocompatibilitécomplexe majeur d'histocompatibilité (CMH). Une fois les présentations faites, le lymphocyte est alors capable de reconnaître les antigènes indésirables et d'anéantir les cellules qui les portent.
Néanmoins, le cancer peut interférer avec ce processus de différentes manières, notamment en réduisant la disponibilité des CMH. L'une des stratégies des chercheurs consiste donc à explorer des voies alternatives pour doter les lymphocytes des récepteurs nécessaires à l'identification des cellules ennemies. C'est le rôle du récepteur antigénique chimériquechimérique (CAR pour Chimeric antigen receptor)), une moléculemolécule développée en laboratoire à partir des lymphocytes du patient. Ces derniers sont prélevés, puis génétiquement modifiés afin de leur faire exprimer un récepteur CAR spécifique à l'antigène produit par les cellules cancéreuses.
Un nouvel espoir
Le traitement, développé par l'équipe du laboratoire Singh de l'université McMaster, en collaboration avec le Jason Moffat Lab de l'université de Toronto, cible spécifiquement la protéineprotéine CD133, présente sur les cellules du glioblastome. Testé chez les souris, il a offert des résultats prometteurs avec une réduction de la charge tumorale et une amélioration de l'espérance de vieespérance de vie. Ces résultats ont mené à la création d'une nouvelle start-upstart-up baptisée Empirica Therapeutics avec pour objectif de mener les premiers tests cliniques pour ce traitement et plusieurs autres en 2022.
« Nous espérons que notre approche consistant à cibler les cellules du glioblastome à l'aide de la thérapiethérapie CAR-T procurera aux patients une meilleure qualité de vie et des chances de survie plus importantes », commente Jason Moffat, responsable scientifique à Empirica Therapeutics. Sheila Singh, cofondatrice de la start-up, ajoute que le traitement offre de nouvelles pistes d'exploration dans l'identification et la destruction de populations de cellules particulièrement agressives du glioblastome, une nouvelle étape dans la lutte contre cette redoutable maladie.
De nouvelles perspectives de traitement pour le cancer du cerveau
Article de l'Inserm, publié le 17 avril 2004
Une équipe de chercheurs de l'unité Inserm 647 dirigée par François Estève, à l'ESRFESRF (ID17) et du CHU (Université Joseph FourierJoseph Fourier) de Grenoble a mis au point un traitement novateur qui améliore la survie de rats présentant des gliomesgliomes (tumeurs du cerveau) à un stade avancé, en combinant chimiothérapie et radiothérapie dans des conditions particulières.
Le gliome est le type de tumeur cérébrale le plus fréquent chez l'homme adulte, et n'a actuellement pas de traitement. Les travaux de ces chercheurs ont montré la disparition de la tumeur chez trois rats sur dix, un an après le traitement. Ces premiers résultats encourageants sont détaillés dans le numéro de CancerCancer Research du 1er avril 2004. Les chercheurs envisagent de lancer des essais cliniquesessais cliniques très prochainement.
Aujourd'hui la duréedurée moyenne de vie des patients atteint de gliome de haut grade est de moins d'une année. De 5 à 10 nouveaux cas pour 100.000 habitants apparaissent chaque année. La radiothérapie traditionnelle a seulement un effet palliatifpalliatif puisque les gliomes sont parmi les tumeurs humaines les plus résistantes à la radiothérapie. Dans la plupart des cas, la chimiothérapie ou la chirurgie ne montrent pas d'efficacité.
Après avoir mené des expériences in vitroin vitro sur des cellules tumorales « F98 »; les chercheurs ont implanté ces cellules dans le cerveau de rat produisant ainsi un modèle animal de tumeur cérébrale. Ce type de tumeur est extrêmement résistant à la radiothérapie et se développe très rapidement. La durée de survie moyenne des rats malades non traités est de 28 jours. Avec la seule chimiothérapie, sous forme d'injection de cis-platineplatine, ils survivent jusqu'à 39 jours. S'ils reçoivent seulement l'irradiationirradiation synchrotron à une longueur d'ondelongueur d'onde optimale, ils peuvent résister au maximum 48 jours.
Dans cette étude, la première phase a consisté à une injection de cis-platine dans le cerveau de rats atteints de gliome. En s'intercalantintercalant dans l'ADNADN des cellules tumorales, le médicament en a limité la prolifération. Le lendemain, les animaux étaient exposés aux rayonnement synchrotronrayonnement synchrotron monochromatique. Les zones contenant la cis-platine ont absorbé cette énergieénergie et détruit l'ADN tumoraltumoral. L'association de la chimiothérapie locale avec l'irradiation synchrotron de longueur d'onde spécifique s'est montrée très efficace et a permis une durée de survie moyenne de 200 jours, soit 6 fois plus que celle des rats non traités.
La différence entre ces rayons Xrayons X et ceux utilisés dans les hôpitaux est la brillance : le faisceau produit par le synchrotron de l'ESRF est cent mille fois plus lumineux que celui produit par les appareils des hôpitaux, ce qui permet de régler le faisceau à la longueur d'onde optimale pour une droguedrogue additive donnée.
Plusieurs techniques thérapeutiques ont été développées ces dernières années sur ce même modèle animal. Cependant, aucune n'a eu de résultats comparables à ceux de ce nouveau traitement combinant cis-platine et rayonnement synchrotron monochromatique.
Le succès de ces essais a conduit les chercheurs à envisager l'élaboration d'un protocoleprotocole pour l'utilisation de ces techniques chez l'homme. Pour François Estève, médecin et directeur de l'unité Inserm 647 et co-auteur de cet article, ce projet nécessitera un important travail de développement technologique. Les chercheurs et médecins ne peuvent affirmer que ces résultats, efficaces sur les animaux, seront transposables à l'homme. Mais ils constituent une piste encourageante dans la recherche d'un traitement curatifcuratif de ce type de cancer du cerveaucancer du cerveau.