À Montpellier, le Cirad travaille sur l'amélioration du riz. L'équipe de recherche de Christophe Périn est focalisée sur les racines, et plus précisément sur les aérenchymes présents dans les racines du riz. Une sorte de « masque et tuba », améliorant la tolérance à la submersion. En ciblant une vingtaine de gènes, ils espèrent repérer les plus impliqués dans la mise en place de ces aérenchymes. Si leurs résultats sont concluants, cela pourrait permettre de sélectionner des variétés de riz et d'autres céréales plus résistantes aux inondations.
au sommaire
Des notes de rap s'échappent de la première porteporte ouverte du couloir. À l'intérieur, Christophe Périn travaille sur son ordinateur portable. Ce chercheur du Cirad (Centre de coopération internationale en recherche agronomique pour le développement) de Montpellier est souvent dans son bureau. Très souvent. « Christophe est l'un des rares chercheurs chef d'équipe à faire encore des manips au labo, parce qu'il est passionné, mais quand on est chef d'équipe on n'a plus le temps », constate Anne-Cécile Meunier, responsable de la partie biologie moléculairebiologie moléculaire du laboratoire.
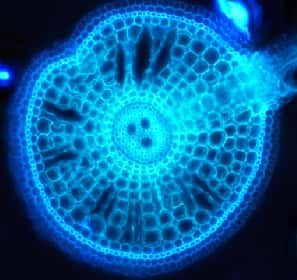
Depuis l'été dernier, l'équipe de Christophe Périn a entamé la phase d'expérimentation de leur nouveau projet : identifier les gènesgènes responsables de la présence d'aérenchymes chez le riz. Les aérenchymes sont des tissus faits de cellules mortes, formant des canaux dans les organes des plantes. Ces canaux servent notamment pour la circulation de l'oxygène dans la plante. Si une céréale grandit les pieds dans l'eau, il est probable qu'elle développe des aérenchymes car ceux-ci l'aident à « respirer » sous l'eau. On parle de tolérance à la submersion. Puisque le réchauffement climatique va accroître les risques d'inondation et donc de submersion des cultures de céréales, avance Christophe Périn, mieux comprendre l'origine génétiquegénétique et le rôle des aérenchymes serait un précieux atout. De nouvelles variétés d'intérêt agricole pourraient en émerger.
De l'indifférence à la serre
Pour décoder les mécanismes entraînant la formation des aérenchymes chez le riz, l'équipe de recherche a prévu de deux à trois ans. En ce moment, la responsable de la production des plantes transgéniques, Aurore Vernet, s'attelle au 2e cycle d'obtention de riz transgéniques. Ces plantes sont modifiées pour que certains gènes ne s'expriment pas, afin d'observer si l'absence de tel ou tel gène impacte la présence des aérenchymes. « On a l'agrément pour faire pousser des plantes OGMOGM et stocker leurs graines », précise-t-elle en descendant dans leurs « sous-sols glauquesglauques », où attendent des rangées de boîtes de Pétri. Elles contiennent des cals de riz.

Un cal est un amas de cellules indifférenciées qu'Aurore Vernet infectera avec une bactérie nommée Agrobacterium tumefaciens. Il est possible d'insérer un gène précis dans le génomegénome du micro-organisme, lequel est capable de transférer une partie de son ADNADN aux plantes. Aurore Vernet est responsable de ce procédé dit de transformation. S'ensuivent plusieurs étapes pour vérifier qu'il s'est déroulé correctement, avant de régénérer des plantes à partir de ces cals transformés. Elle hausse les épaules : « Le 1er cycle ne donnera rien, le protocoleprotocole a été mal construit, mais ça fait partie des aléas. »

Lorsque les jeunes riz sont au stade de plantules, ils sont déplacés dans une serre adaptée à la culture d'OGM. Après l'entrée, où chacun revêt une blouse et des surchaussures, se trouve un sas pour prévenir les disséminations. « Ma partie est la moins scientifique », rigole Eve Lorenzini, un peu gênée derrière son masque. Sous quelque 30 °C et 60 % d'humidité, la blouse semble lourde. Entre deux rangs de plantes, cette serriste - spécialiste des cultures en serre - présente les insectesinsectes auxiliaires du riz. Des acariensacariens se nourrissant d'autres acariens, ce qui protège les plants d'éventuels ravageurs.

De retour dans son bureau, Eve Lorenzini ouvre le site collaboratif dédié à la traçabilitétraçabilité. Chaque lot de graines d'une même plante est étiqueté d'un code-barrescode-barres, afin de faciliter l'identification et l'archivagearchivage. Graines mises en sachet au sein d'une pièce dédiée, qui « serait mieux rangée si je ne revenais pas de deux mois d'arrêt maladie », soupire la serriste.

Pour commencer
Les expériences menées par l'équipe de Christophe Périn nécessitent, comme tout projet, un financement. « Il y a souvent un délai entre l'idée et l'argentargent que l'on nous donne, donc parfois on démarre avec l'argent d'un autre projet », confie Aurore Vernet. Un fonctionnement en flux tendu, où chaque projet démarre avec les fonds restants d'un autre. Ces fonds proviennent du secteur privé ou du secteur public. Ou des deux.
Pour cette étude, les financements sont issus de l'Agence nationale de la recherche (ANR), une agence française chargée de distribuer des moyens financiers aux projets de recherche. Disposant elle-même d'insuffisamment de fonds, elle est très sélective. En 2019, quelque 16 % des projets déposés ont reçu un financement. Un chiffre en légère hausse année après année - 15 % en 2018, 13 % en 2017. Surtout, les chercheurs déboutés peuvent retenter leur chance. Dans le cas de Christophe Périn, après deux refus, la troisième tentative fut la bonne. L'argent reçu a permis, d'une part, d'amorcer officiellement le projet et, d'autre part, de recruter une personne en thèse.

Un protocole en trois ans
Embauché il y a deux mois, Dylan Gallo a effectué son stage de fin de master dans la même équipe, sur le même sujet. Pour expliquer l'objet de sa thèse, il attrape un tableau blanc et un feutre. Concrètement, il a trois ans pour mettre au point un protocole fonctionnel, afin de décrypter et valider les réseaux de gènes impliqués dans la mise en place des aérenchymes. « C'est bien de savoir que sans tel gène ça ne marche pas, mais il faut comprendre pourquoi et identifier les réseaux, donc quel gène régule quel gène. »

Actuellement, il épluche la littérature scientifique pour mettre ses connaissances à jour. Un travail de bibliographie qui devrait déboucher sur un premier article, dit de « review », puisque tous les articles scientifiques n'exposent pas les résultats d'une équipe de recherche. Certains, par exemple, retracent l'état de l'art sur une question donnée. D'ordinaire, les chercheurs publient en amont, durant, et après leurs expériences.
Cela est d'autant plus important que le système de publication scientifique est contestable. Bien que chacun travaille « pour mettre sa pierre à l'édifice », raconte Dylan Gallo, la première équipe à publier est davantage valorisée. C'est une course. Les équipes suivantes confirment ou infirment les résultats des vainqueurs. Ce qui est d'une valeur précieuse, d'un point de vue scientifique, mais leurs travaux sont tout de même moins reconnus. Leur renommée ? Moindre également. Le jeune chercheur éclate d'un rire jaune : « Dans un jeu de société, tu gagnerais des points d'orgueil. »

« Chop chop »
Avant de débuter ces recherches, Christophe Périn a dû compléter une étape préliminaire : caractériser des gènes « candidats ». Le responsable de l'imagerie, Sergi Navarro Sanz, et lui ont repéré plusieurs gènes qu'ils suspectent liés aux aérenchymes. « On a conçu ou adapté les techniques nécessaires », indique Christophe Périn, dont une technique de microdissection laser pour séparer les tissus à l'intérieur d'une racine de riz.
Ceci étant fait, Sergi Navarro Sanz échafaude les designs des expériences. Pour qu'Aurore Vernet puisse transformer du riz avec Agrobacterium tumefaciens, il faut créer le plasmideplasmide artificiel que la bactériebactérie injectera dans la plante. Un plasmide est constitué d'ADN mais, contrairement aux chromosomeschromosomes, les plasmides sont circulaires. Ce sont des rondes de gènes.

Grâce à la technologie CRISPR-Cas9, les chercheurs peuvent insérer ou inactiver précisément un ou plusieurs gènes. Pour inactiver, il faut « trouver une séquence de 20 nucléotidesnucléotides [les briques constitutives de l'ADN, ndlr] unique où CRISPR-Cas9CRISPR-Cas9 pourra couper », détaille Sergi Navarro Sanz. Une séquence qu'il peut dénicher à l'aide d'un logiciellogiciel, puisque le génome du riz est entièrement séquencé. Lorsque « CRISPR-Cas9 voyage sur l'ADN, elle reconnaît cette séquence unique et chop chop, elle coupe ».
Une fois coupé, le gène visé n'est plus fonctionnel. On parle de « knock-out » ou, dans le jargon, de KO. Les chercheurs peuvent ainsi tester un par un leurs gènes candidats, grâce à la création d'un plasmide artificiel par gène. Injecté dans une plante, celui-ci permet d'observer ce qu'il advient quand le gène ciblé est inactivé.
Le design du plasmide terminé, reste à le produire. Anne-Cécile Meunier, responsable de la partie biologie moléculaire du laboratoire, entre en scène. « Durant mes études, on était 7 ou 8 sur 60 à être passionnés de biologie moléculaire... On était les extraterrestres ! » Seule dans le laboratoire, Anne-Cécile Meunier remplit de petits tubes avec des enzymes et des séquences génétiques pour fabriquer le plasmide artificiel. Elle teste les outils nécessaires à ses « manips », dans l'espoir d'en réutiliser certains lors de prochaines expériences. « Tous les projets de recherche fonctionnent comme ça, explique-t-elle. On part de données préliminaires et on fait des paris. »
Si ce pari est fructueux, cela se révélera dans plusieurs mois. Une fois toutes les étapes complétées, les plants de riz transformés seront scrutés au microscopemicroscope. L'absence d'aérenchymes ou leur présence excessive signifiera que l'équipe de Christophe a dégoté des gènes pertinents. Ouvrant la voie à de plus amples analyses voire à la sélection de variétés de riz - et d'autres céréales - plus intéressantes pour l'agricultureagriculture, car leurs résultats seront publics.
























