L'électronégativité des éléments chimiques est une des clés du comportement de la matière car elle influe sur les liaisons chimiques des atomes dans les molécules et les cristaux. Une première théorie en avait été faite par le prix Nobel Linus Pauling et d'autres avaient suivi au cours des décennies. La dernière en date est développée depuis quelques années par le célèbre physicien et chimiste russe Artem Oganov et ses collaborateurs. Elle ouvre de nouvelles perspectives, en planétologie notamment, comme l'origine de l'eau sur Terre, mais aussi pour des supraconducteurs à haute température.
au sommaire
Cela fait des années que Futura fait écho aux travaux du physicien, chimiste et cristallographe russe Artem Oganov, dont le nom revient assez souvent sur le devant de la scène de la physico-chimie des matériaux à haute pression. Sa trajectoire l'a conduit dans plusieurs centres de recherche mondiaux de grande réputation, de l'Université d'État de Moscou jusqu'à l'Université Stony Brook en passant par l'University College London et l'ETH à Zurich. De retour en Russie et après avoir été membre un temps du mythique Institut de physique et de technologie de Moscou, il a réalisé ses travaux dans le cadre du Skolkovo Institute of Science and Technology (Skoltech) que l'on peut considérer comme l'équivalent russe du MIT aux États-Unis.
Futura avait récemment parlé d'une de ses dernières contributions, et elle était d'importance car elle résout peut-être l’énigme de l’origine de l’eau sur Terre. Toujours dans le cadre de la physique des hautes pressions que l'on peut étudier en laboratoire avec des cellules à enclumes de diamant, mais aussi théoriquement avec de savants algorithmes sur ordinateurordinateur, Artem Oganov et ses collègues avaient été conduits à revoir certaines des lois fondamentales de la chimie telles qu'on les a découvertes en explorant le comportement de la matière dans des conditions ordinaires.
Futura avait ainsi expliqué dans le précédent article, ci-dessous, auquel nous renvoyons pour lecture avant de continuer à lire cet article, que le chercheur russe et ses collaborateurs avaient été conduits à étendre pour la modifier la théorie de l'électronégativité pour les éléments chimiqueséléments chimiques telle qu'elle avait été initialement comprise et développée par le prix Nobel de Chimie Linus PaulingLinus Pauling et plus précisément aussi par un autre prix Nobel de chimie : Robert S. Mulliken.
Avec des collègues chinois, Artem Oganov a publié début mars un article qui fait un bilan de ses recherches commencées de longue date en ce qui concerne justement l'électronégativité des éléments à haute pression. L'article en question est en accès libre et il se trouve dans le célèbre journal Proceedings of the National Academy of Sciences.
Il existe un long communiqué de Skoltech à ce sujet que l’on peut lire, mais dont nous traduisons ici quelques passages pour donner déjà une idée de son contenu.

Dans le communiqué en question, Artem Oganov donne un exemple simple qui permet de commencer à comprendre pourquoi on a introduit la notion d'électronégativité à partir des expériences montrant que les réactions chimiquesréactions chimiques faisaient intervenir des transferts et des partages de charges électriques entre les éléments : « Déposez un morceau de cuivrecuivre dans un verre d'eau et il ne se passe pas grand-chose. Pourtant, si vous laissez tomber un morceau de sodiumsodium dans l'eau, une réaction chimique violente s'ensuit, générant suffisamment de chaleurchaleur pour faire fondre le sodium. La raison en est l'électronégativité exceptionnellement faible du sodium : il est très désireux d'abandonner ses électronsélectrons au profit d'autres atomesatomes ». En fait, on peut utiliser cette notion pour prédire quand et de quelle façon des réactions chimiques vont se produire entre des atomes et finalement des moléculesmolécules car c'est une mesure de la capacité d'un élément à céder ou capter des électrons d'un autre élément. Aussi, plus une différence d'électronégativité est élevée entre deux éléments, plus une réaction chimique violente peut se produire.
Une nouvelle chimie à l'intérieur des planètes
On sait que ces propriétés chimiques dépendent de la structure des couches électroniquescouches électroniques autour des noyaux des éléments. On peut modéliser ces couches et le comportement des électrons dans ces couches en utilisant les lois de la mécanique quantiquemécanique quantique (par exemple avec la théorie de la fonctionnelle de la densité qui tire ses origines du modèle de Thomas-Fermi). On peut les mettre sur ordinateur pour prédire par le calcul ce qui va se passer lorsque les atomes sont contraints d'être fortement rapprochés les uns des autres en comprimant un échantillon de matière. On peut aussi faire des expériences pour confirmer les résultats de ces calculs et justement il y a eu plusieurs prédictions couronnées de succès en implémentant sur ordinateur un algorithme nommé Uspex (Universal Structure Predictor : Evolutionary Xtallography). On le doit initialement à Artem Oganov et il est utilisé par plus de 7.000 chercheurs dans le monde, permettant de prédire victorieusement (en russe uspekh signifie « succès ») non seulement la structure cristalline que vont adopter les atomes formant un matériaumatériau d'une composition chimique initiale donnée dans des conditions de pression et de température variées mais aussi l'apparition de propriétés nouvelles et exotiquesexotiques de la matière à haute pression.
Comme le rappelle dans le communiqué de Skoltech Artem Oganov : « Nous en savons énormément sur la façon dont les substances se comportent sous la pression atmosphériquepression atmosphérique, mais à bien y penser, ce n'est pas du tout une situation typique. La majeure partie de la matière de la Terre et celle des autres planètes existent sous d'énormes pressions - près de 4 millions d'atmosphèresatmosphères au centre de la Terre, par exemple. »
Parmi les nouveautés de la chimie et de la physique des hautes pressions le même communiqué en mentionne plusieurs, dont voici quelques exemples que nous reprenons presque verbatim en traduction :
- À des pressions suffisamment élevées toute substance devient un métalmétal. Fait intéressant, le sodium métallique devient d'abord diélectriquediélectrique, à 2 millions d'atmosphères, avant de se métalliser à nouveau définitivement sous une compression encore plus importante.
- Les gazgaz inertes ne sont plus inertes et forment des composés. Même l'hélium !
- Deux éléments quelconques, même le sodium et le chlorechlore apparemment ennuyeux dans le sel de table (NaCl), forment des composés étranges régis par des règles mystérieuses : Na3Cl, NaCl7, etc. Incidemment, parmi ces substances anormales figurent des supraconducteurs à haute température record tels que H3S, LaH10, YH6, etc.
- Des valencesvalences anormalement élevées sont observées. Le césiumcésium et le cuivre, par exemple, atteignent respectivement les valences cinq et quatre.
- Le cuivre et le borebore, le magnésiummagnésium et le ferfer et d'autres combinaisons d'éléments qui ne réagissent jamais à la pression atmosphérique forment des composés.
En modifiant la description de l'électronégativité, ainsi que celle du concept de « duretédureté chimique » (chemical hardness) développé initialement par RalphRalph Gottfrid Pearson, Artem Oganov et ses collègues ont donc réussi à expliquer l'apparition de ces nouveaux phénomènes, ouvrant de nouvelles perspectives pour la géologiegéologie, la planétologie et d'autres sciences.
Pour recréer les conditions régnant dans les profondeurs des planètes, et plus généralement pour étudier le comportement de la matière à haute pression, des échantillons peuvent être placés entre les pointes de deux diamants. Les diamants sont alors pressés l’un contre l’autre afin de produire les pressions très élevées demandées par les expériences. Un faisceau laser infrarouge peut alors chauffer l’échantillon jusqu’à 1.000 °C et plus. Traduction en français en cliquant sur le rectangle blanc en bas à droite, puis sur l'écrou, ensuite sur « Sous-titres » et « Traduire automatiquement ». © Carnegie Science
Chimie : la théorie de l'électronégativité du prix Nobel Linus Pauling a été corrigée
L'électronégativité des éléments chimiques est une des clés du comportement de la matière car elle influe sur les liaisons chimiquesliaisons chimiques des atomes dans les molécules et les cristaux. Une première théorie en avait été faite par le prix Nobel Linus Pauling et d'autres avaient suivi au cours des décennies. La dernière en date fait les honneurs du prestigieux journal Nature Communications.
Comme Futura l'expliquait dans un précédent article, le rideaurideau de fer de la guerre froide a parmi ses effets causé l'ignorance de plusieurs grands noms de la science russe du XXe siècle à l'Ouest, en dehors du cercle restreint des spécialistes européens et américains. Qui par exemple est familier encore de nos jours avec les noms des prix Nobel de physique Lev Landau et Piotr Kapitsa ? Si l'on doit chercher du côté des prix Nobel de chimie, qui a entendu parler de Nikolaï Semionov et de ses travaux sur les réactions en chaîneréactions en chaîne en chimie ? Enfin, qui a entendu parler de l'Institut de physique et de technologie de Moscou (MIPT pour Moscow Institute of Physics and Technology, Московский Физико-Технический институт, en russe), baptisé PhysTech (Физтех), comme on parle de l'X en France ou du MIT aux États-Unis, et qui a été fondé après la seconde guerre mondiale par ces trois prix Nobel ?
Un cours du prix Nobel Linus Pauling sur la liaison chimique. Pour obtenir une traduction en français assez fidèle, cliquez sur le rectangle blanc en bas à droite. Les sous-titres en anglais devraient alors apparaître. Cliquez ensuite sur l'écrou à droite du rectangle, puis sur « Sous-titres » et enfin sur « Traduire automatiquement ». Choisissez « Français ». © Oregon State University
Linus Pauling et la liaison chimique quantique
En ce qui concerne la chimie, et de l'autre côté de l'Atlantique à la même époque, l'une des stars et également prix Nobel s'appelait Linus Pauling. On lui doit des travaux fondamentaux sur la nature de la liaison chimique qu'il a aidée à élucider en faisant intervenir dans les années 1930 la toute jeune mécanique quantique via sa théorie de l'hybridationhybridation des orbitalesorbitales atomiques.
Au cours de la même période il va reprendre, pour le corriger, le concept d'électronégativité introduit pour la première fois par le chimiste suédois Jöns Berzelius en 1819. Il en fera vers 1932 la théorie moderne associée à ce qui est appelé l'échelle d'électronégativité de Pauling pour les éléments chimiques. Autant dire que même encore aujourd'hui, il reste inspirant de lire les ouvrages de Pauling, aussi bien son introduction à la chimie générale que son traité sur la liaison chimique, voire son traité de chimie quantique. (Par contre, vers la fin de sa vie, ses travaux sur la vitamine Cvitamine C sont hélas devenus un exemple de ce que l'on appelle la maladie du Nobel).
Faisons quelques rappels rapides sur la notion d'électronégativité. Il est admis depuis les travaux du physicienphysicien et chimiste états-unien Gilbert Lewis vers 1916 qu'une liaison chimique, en particulier covalente, est une mise en commun d'électrons. Les idées de Lewis (à qui l'on doit le nom de photonphoton pour les quanta de lumièrelumière d'EinsteinEinstein) se sont retrouvées justifiées par la découverte de la mécanique quantique. On peut montrer alors que les densités de probabilités de présence des électrons autour des noyaux d'atomes et dans les molécules sont plus ou moins équivalentes à des densités de charges électriques. Tout se passe alors comme si certains atomes concentraient plus ou moins une charge électrique négative autour d'eux dans une liaison chimique, donnant éventuellement lieu à l'existence d'un moment dipolairemoment dipolaire, comme le disent les chimistes et les physiciens dans leur jargon. La liaison chimique devient alors polarisée, toujours dans ce même jargon.
L'électronégativité d'un élément chimique comparée à celle d'un autre est donc une mesure de la capacité du premier à concentrer une charge électrique négative à son avantage lors de l'établissement d'une liaison chimique. La connaissance et la classification des électronégativités des éléments aident donc à prédire et à comprendre quels types de liaisons chimiques ils vont pouvoir former, leur stabilité et finalement des énergiesénergies de réactions chimiques ainsi que des propriétés de certains cristaux. Pauling a donc fourni une formule et une classification pour rendre compte de l'électronégativité. Elles sont les plus utilisées mais par la suite d'autres ont été proposées, comme celle de Robert S. Mulliken.
Une présentation d'une star de la physique russe et de ses travaux en physique du solide. Pour obtenir une traduction en français assez fidèle, cliquez sur le rectangle blanc en bas à droite. Les sous-titres en russe devraient alors apparaître. Cliquez ensuite sur l'écrou à droite du rectangle, puis sur « Sous-titres » et enfin sur « Traduire automatiquement ». Choisissez « Français ». © Skoltech
Quid de l'électronégativité à haute pression ?
Aujourd'hui, c'est une nouvelle révision de l'échelle de Pauling qui vient d'être publiée dans un article du prestigieux journal Nature Communications. On la doit au physicien, chimiste et cristallographe russe Artem Oganov, en compagnie de son collègue Christian Tantardini, au Skolkovo Institute of Science and Technology (Skoltech) que l'on peut considérer comme l'équivalent russe du MIT aux États-Unis. Futura a déjà consacré plusieurs articles aux découvertes faites par Artem Oganov avec ses collègues et collaborateurs dans le domaine de la physique et de la chimie des hautes pressions. Le précédent article ci-dessous en témoigne. Pour faire un peu plus connaissance avec Artem Oganov et ses travaux, la vidéo ci-dessus est un bon départ.
Dans un communiqué du Skoltech, Artem Oganov explique le résultat qu'il a obtenu avec Christian Tantardini et qui est mis à l'honneur dans une sélection de Nature Communications :
« Tout a commencé lorsque nous avons décidé de calculer les électronégativités de Pauling sous pression. La chimie des hautes pressions est assez exotique, mais on sera probablement en mesure de comprendre beaucoup de choses une fois que l'on aura découvert comment les électronégativités des éléments changent sous la pression. Nous avons utilisé la définition de Pauling pour calculer l'électronégativité dans des conditions normalesconditions normales et avons été étonnés de découvrir que son échelle ne correspondait pas aux énergies de liaison théoriques ou expérimentales pour des molécules significativement ioniques. De plus, de nombreuses publications dans la littérature chimique mentionnaient ce problème mais aucune n'offrait de solution cohérente. J'ai compris que la raison principale en était que Pauling traitait la stabilisation ionique de la molécule comme un effet additif, alors que si nous la considérons comme un effet multiplicatif, de nombreux inconvénients seront supprimés. Avec la nouvelle formule et les énergies expérimentales des liaisons chimiques, nous avons déterminé les électronégativités de tous les éléments et obtenu une belle échelle qui fonctionne aussi bien pour les petites que pour les grandes différences d'électronégativité. »
Une présentation de Skoltech. Pour obtenir une traduction en français assez fidèle, cliquez sur le rectangle blanc en bas à droite. Les sous-titres en anglais devraient alors apparaître. Cliquez ensuite sur l'écrou à droite du rectangle, puis sur « Sous-titres » et enfin sur « Traduire automatiquement ». Choisissez « Français ». © Skoltech
Le sel de cuisine défie les règles de la chimie à haute pression
Article de Laurent SaccoLaurent Sacco publié le le 05/01/2014
On sait qu'à hautes pressions, l'hydrogènehydrogène devient un métal conducteur. Des chercheurs viennent de confirmer que même du sel de cuisine ordinaire devient exotique en se transformant en d'autres matériaux à plus de 200.000 atmosphères. Voilà de quoi rendre encore plus prudents les géophysiciens qui cherchent à pénétrer les mystères de l'intérieur des planètes et, à plus long terme, des exoplanètesexoplanètes.
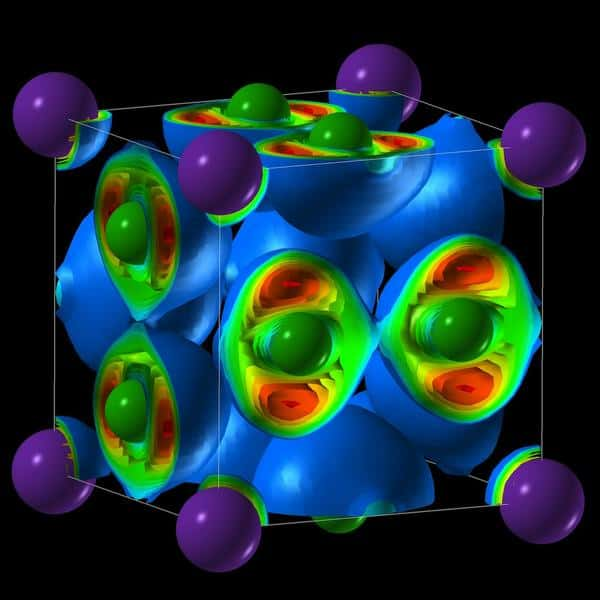
Une équipe internationale de physiciens vient de publier dans Science les résultats de travaux qui auraient sans aucun doute intéressé Percy Williams Bridgman (1882-1961), l'un des pionniers de la physique des hautes pressions. En mettant au point une technique permettant de soumettre des échantillons de matière à des pressions dépassant 100.000 atmosphères, le physicien a fait des découvertes qui lui ont valu le prix Nobel de physique de 1946. On peut citer par exemple celle de l'existence de nouvelles phases de la glace.
On lui doit surtout l'idée des cellules à enclumes, qui ont permis de faire des expériences concernant l'état des roches à l'intérieur de la Terre ou de la matière dans le cœur des planètes géantesplanètes géantes comme Jupiter. Les cellules à enclumes de Bridgman étaient initialement composées de carburecarbure de tungstènetungstène. Elles ont pavé la voie aux cellules à enclumes de diamant, que l'on utilise aujourd'hui de façon routinière pour les expériences de physique à haute pression.

Enclumes de diamant et synchrotron à rayons X
L'équipe de physiciens a utilisé ces cellules à enclumes de diamant pour porter du simple sel de cuisine à une pression de plus de 200.000 atmosphères et à une température de 2.000 K à l'aide de faisceaux laserlaser (pour mémoire, la pression au centre de la Terre est évaluée à 3,6 millions d'atmosphères et sa température à 6.000 K). Les caractéristiques des matériaux obtenus dans ces conditions ont été analysées à l'aide de la méthode de diffractiondiffraction des rayons Xrayons X, comme les chercheurs l'expliquent dans l'article qu'ils ont mis en ligne sur arxiv. Pour cela, ils ont utilisé une ligne de lumière du synchrotron Petra III du Desy (Deutsches Elektronen-Synchrotron, synchrotron allemand à électrons). Le but de ces expériences était de vérifier les calculs théoriques faits sur ordinateur par l'équipe que dirige un physicien du solidesolide russe bien connu pour ses travaux sur le bore et le sodium, ou encore sur le germane : Artem Oganov.

D'ordinaire, comme tous les étudiants en physique et en chimie l'apprennent depuis des décennies, les liaisons chimiques obéissent à quelques règles simples comme celle de l'octetoctet. Elle énonce que les atomes avec un numéro atomiquenuméro atomique (Z) supérieur à quatre tendent à se combiner de façon à avoir huit électrons dans leur couche de valence (couche externe), ce qui leur donne la même structure électronique qu'un gaz noble.
Appliquée à un atome de sodium (Na), qui possède un électron sur sa couche de valence, donc un de plus que l'atome de néonnéon, et à un atome de chlore (Cl) à qui il en manque un pour avoir une couche de valence aussi remplie que l'atome d'argonargon, cette règle conduit à prédire l'existence de NaCl, le sel de cuisine ordinaire. Énoncée par le chimiste Gilbert Lewis (à qui l'on doit la dénomination de « photon »), la règle de l'octet possède tout de même quelques exceptions. Cependant, on ne s'attendait pas à ce qu'un solide ionique, en l'occurrence des cristaux de sel, ne lui obéisse plus à hautes pressions.
De nouveaux matériaux à haute pression à partir de sel
Pourtant, l'algorithme mathématique qu'Artem Oganov a fait tourner sur ordinateur prédisait sans ambiguïté qu'au-delà de 200.000 atmosphères, des solides aussi exotiques que Na3Cl et NaCl3 devaient exister. Il devait suffire de prendre un mélange de sel et de sodium métallique dans le premier cas et de sel avec du chlore dans le second cas et de compresser suffisamment en chauffant. Non seulement c'est bien le cas, mais une fois formés, ces nouveaux matériaux restent stables thermodynamiquement.
Ils ne seraient que la pointe émergée d'un iceberg, car des associations de sodium et de chlore comme NaCl7, Na3Cl2 et Na2Cl ont aussi été prédites. Surtout, cela conduit à penser que d'autres matériaux n'obéissant pas aux règles habituelles de la chimie doivent exister à haute pression. « Les règles de la chimie ne sont pas des théorèmesthéorèmes mathématiques intangibles, explique Artem Oganov. Les lois de la chimie peuvent être contournées, car "impossible" signifie en réalité pour elles "difficilement réalisable". Vous avez juste besoin de trouver les conditions pour faire pencher la balance des énergies d'un côté, et ces règles ne tiennent plus. »