au sommaire
Depuis quelques années, le nom du physicienphysicien, chimiste et cristallographe russe Artem Oganov (professeur à l'université Stony Brook et au MIT russe, le Skolkovo Institute of Science and Technology)) revient assez souvent sur le devant de la scène de la physico-chimie des matériaux à hautes pressions. Il s'inscrit sans doute dans la longue tradition de l'école de physique russe en physique de la matière condensée, et on lui doit plusieurs découvertes remarquables dans les domaines de la supraconductivité, des métamatériauxmétamatériaux, du graphène ou de certaines quasi-particules. Des découvertes auxquelles les noms de Lev Landau, Victor Veselago, Yakov Frenkel, Andre Geim et Konstantin Novoselov sont associés.
Nous ne sommes donc pas surpris de la publication dans le journal Nature Chemistry d'un article où Artem Oganov et ses collègues font état de leurs travaux sur des cristaux à base d'héliumhélium et de sodiumsodium, d'abord prédits théoriquement puis synthétisés et observés à hautes pressions dans une cellule à enclume de diamantdiamant. La découverte est d'importance car, selon les règles de la chimie traditionnelle, l'hélium est le gazgaz rare par excellence. Il ne devrait donc pas posséder de véritable chimie, car on ne devrait pas pouvoir le trouver dans des moléculesmolécules ou encore associé par liaison chimiqueliaison chimique dans des cristaux.
Une présentation des travaux d'Artem Oganov. Pour obtenir une traduction en français assez fidèle, cliquez sur le rectangle blanc en bas à droite. Les sous-titres en anglais devraient alors apparaître. Cliquez ensuite sur l'écrou à droite du rectangle, puis sur « Sous-titres » et enfin sur « Traduire automatiquement ». Choisissez « Français ». © Stony Brook University
Mais ces règles peuvent changer à hautes pressions comme l'a expliqué une fois Artem Oganov : « Les règles de la chimie ne sont pas des théorèmesthéorèmes mathématiques intangibles. Les lois de la chimie peuvent être contournées, car "impossible" signifie en réalité pour elles "difficilement réalisable". Vous avez juste besoin de trouver les conditions pour faire pencher la balance des énergiesénergies d'un côté, et ces règles ne tiennent plus ».
Il existe donc bien une chimie de l'hélium qui pourrait bien avoir de l'importance dans la compréhension des planètes géantesplanètes géantes comme JupiterJupiter ou SaturneSaturne, constituées essentiellement d'hydrogènehydrogène et d'hélium, et où des pressions dépassant le million d'atmosphèresatmosphères existent.
Des cristaux ioniques d'hélium et de sodium
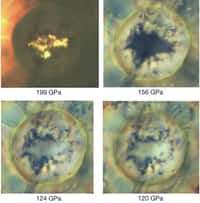
Dans de précédents travaux, Artem Oganov et ses collègues s'étaient déjà intéressés à la chimie exotiqueexotique du chlorure de sodium et des matériaux carbonés dans les géantes gazeuses. Ils s'inscrivaient dans un thème de recherche plus général, celui de la prédiction ab initio de nouveaux matériaux à l'aide de simulations numériquessimulations numériques sur ordinateurordinateur. Celles-ci sont basées sur un algorithme nommé Uspex (Universal Structure Predictor: Evolutionary Xtallography). Aujourd'hui, Oganov et son collègue Xiao Dong annoncent donc avec d'autres chercheurs avoir démontré l'existence de deux composés prédits à l'aide d'Uspex, à savoir Na₂He et Na₂He O. Les expériences qui le prouvent ont notamment été menées par Alexander F. Goncharov, Elissaios Stavrou et Sergey Lobanov du célèbre Carnegie Institution for Science à Washington.
Les deux nouveaux matériaux ont été synthétisés à des pressions de l'ordre de 0,1 à 1 million d'atmosphères. Il s'agit dans les deux cas de cristaux ioniques analogues à ceux de structure cubique qui forment la fluorinefluorine. Les atomesatomes de sodium y jouent le rôle de cationcation chargé positivement mais ils sont liés électrostatiquement à des paires d'électronsélectrons fortement localisés dans le cas de Na₂He et à O²⁻ dans le cas de Na₂He O. Ces cristaux se comportent donc comme des isolants, car les électrons n'y sont pas libres de se déplacer.