au sommaire
La pollution par l'ozone constitue un cas complexe qui, sur le plan médiatique est généralement l'objet d'erreur, d'interprétation et, sur le plan scientifique, l'objet de conclusions parfois contestables.
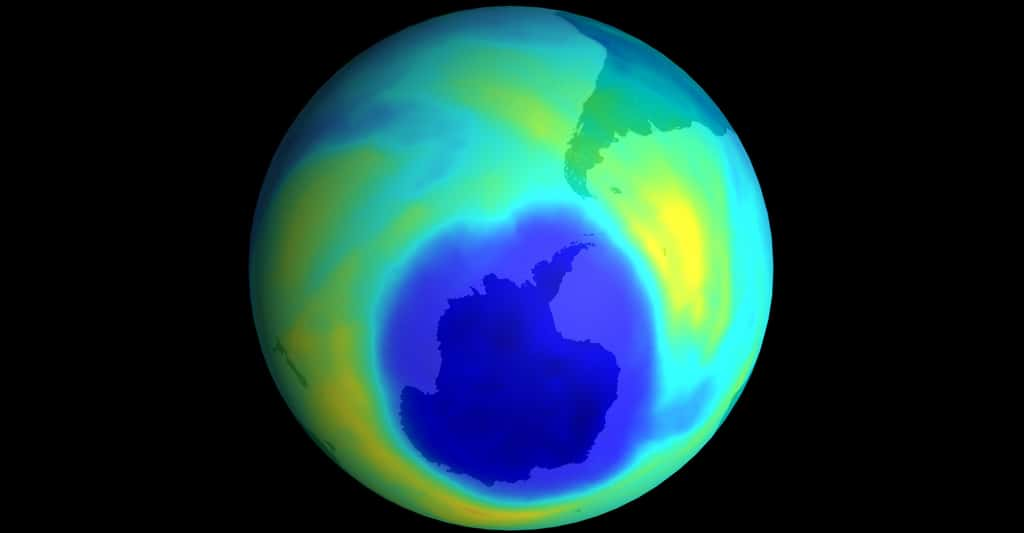
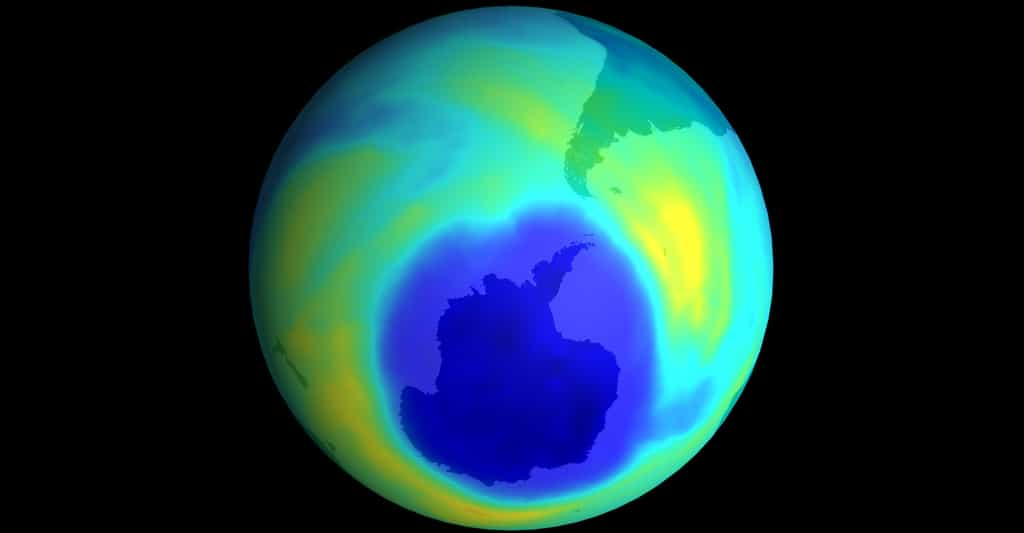
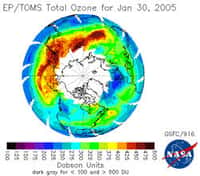
Trou dans la couche d'ozone. © NASA Domaine public
Généralement, la présence d'ozone dans la troposphèretroposphère est présentée comme une pollution nouvelle produite par l'activité humaine et, plus spécialement, par la circulation automobileautomobile. Or, la présence d'ozone dans la troposphère n'est pas un fait nouveau ; l'ozone est un constituant naturel de l'atmosphèreatmosphère, de la troposphère comme de la stratosphèrestratosphère.
Sur le plan de la santé, il règne aussi une grande confusion sur les effets pathogènespathogènes de l'ozone. Lors des périodes de pollution photo-oxydante (qui se produisent, en été, par fortes chaleurs et ensoleillement et conditions météorologiques défavorables pour la dispersion des polluants) les sensations désagréables ressenties par la population sont attribuées à l'ozone alors que les symptômessymptômes correspondent à d'autres polluants.
Mécanismes de formation de l'ozone
Les mécanismes de formation sont très différents selon qu'il s'agisse de l'ozone stratosphérique ou de l'ozone troposphériqueozone troposphérique.
L'ozone stratosphérique
L'ozone (O3)) est formé par action sur l'oxygène du rayonnement ultraviolet de longueur d'onde inférieur à 240 nanomètresnanomètres (nm) selon la réaction de dissociation :
<map name="*"><area shape="rect" coords="178,4,201,27" href="/#(*)" /></map>
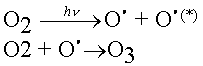
L'ozone est décomposé par les radiations UV de longueur d'onde inférieure à 310 nm.
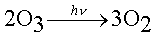
Il résulte des deux réactions que les radiations solaires de longueurs d'ondes inférieures à 310 nm sont arrêtées dans la stratosphère et ne parviennent donc pas dans la basse atmosphère.
La concentration en O3 de la stratosphère (appelée « couche d'ozonecouche d'ozone ») dépend des vitessesvitesses relatives de formation et de destruction. Cette concentration n'a pas présenté de variations sensibles depuis une trentaine d'années qu'elle est mesurée, à l'aide du spectrophotomètre Dobson. La concentration moyenne en O3 est de 300 « unités Dobson », ce qui correspond à une « couche d'ozone » de 3 mm d'épaisseur, calculée dans les conditions normales de température et de pressionconditions normales de température et de pression.
La concentration en O3 de la stratosphère est bien plus grande que celle de la troposphère. On considère qu'une partie de l'ozone présent dans la troposphère provient de la stratosphère.
L'ozone troposphérique
Comme les radiations solaires de longueurs d'onde inférieure à 240 nm sont entièrement arrêtées dans la stratosphère, c'est par un mécanisme différent que l'ozone se forme dans la troposphère. Cependant, le seul mécanisme de formation de O3 est la réaction entre l'oxygène O2 et l'atomeatome d'oxygène O :
O2 + O --> O3
Dans la troposphère, l'atome d'oxygène O ne peut guère provenir que de la photolysephotolyse du dioxyde d'azoteazote NO2 :
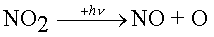
par action de radiations de longueurs d'onde inférieures à 400 nm.
Du fait de ces deux réactions, on considère souvent que ce sont les oxydes d'azoteoxydes d'azote qui sont la cause de l'existence de fortes concentrations en ozone. Ce n'est que partiellement exact.
En effet, la formation d'ozone est limitée par la réaction entre NO et O3 :
NO + O3 --> NO2 + O2
Pour que les oxydes d'azote puissent former de fortes concentrations en ozone, il faut que le rapport des concentrations
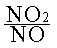
Parmi la multitude de réactions possibles citées dans la littérature, nous indiquerons quelques réactions qui interviennent dans le processus de la formation d'ozone :
1) formation de radicaux libres * R


RH + O --> R


2) réactions des radicaux libres avec l'oxygène O2 avec forma-tion de peroxydes HO


R


O




Réaction avec l'oxyde de carbonecarbone CO :
O


H


3) Oxydation du monoxyde d'azotemonoxyde d'azote NO :
NO + RO


NO + HO


avec régénération de NO2 et des radicaux libres.
Un autre mode de formation de radicaux libres est l'oxydation d'hydrocarbures éthyléniques :
R - CH=CH - R + O2
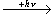
Il y a formation d'aldéhydealdéhyde RCHO qui peut être transformé selon les réactions suivantes :
- par photo dissociation :
RCHO
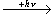


ou H


- par réaction photochimique avec O2 :
RCHO + O2
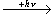


L'oxydation du radical RO

RO


Les aldéhydes, qui se forment aussi par oxydation incomplète des hydrocarbures dans les foyersfoyers de combustioncombustion et dans les moteurs, jouent un rôle notable dans la pollution photo-oxydante. Les aldéhydes sont en effet des composées irritants pour les muqueusesmuqueuses de l'appareil respiratoireappareil respiratoire et pour les yeuxyeux.
Concentrations moyennes en ozone en milieu naturel et en milieu urbain
La concentration moyenne en O3 est nettement plus forte dans le milieu naturel que dans l'atmosphère des villes. Dans celles-ci, la teneur élevée de l'airair en monoxyde d'azote (NO) limite la formation d'O3 comme indiqué précédemment selon la réaction :
NO + O3 --> NO2 + O2
En milieu rural, la concentration en oxydes d'azote, et particulièrement en NO, est bien plus faible qu'en milieu urbain, cependant que les précurseurs de la formation d'ozone, les composés organiques volatiles (COV) sont présents en concentration notable. Les COV sont produits par les végétaux, notamment par les forêts. On estime que les forêts françaises émettent environ 1 million de tonnes de COV par an, soit autant que les émissionsémissions dues aux transports, voitures et camions. Notons que les arbresarbres produisent aussi directement de l'ozone au cours de la synthèse chlorophyllienne.
Certains auteurs considèrent que l'O3 présent en milieu rural n'est pas dû à des phénomènes naturels mais provient de la pollution des villes transportée par les ventsvents vers l'espace rural. C'est sans doute parfois exact, pour les campagnes voisines des villes mais les mesures effectuées en des lieux très éloignés de toute activité humaine contredisent cette hypothèse. Ainsi, en plein Sahara, on trouve une concentration moyenne de 60 µg d'O3 par m3. A la station forestière Duchesney, au Québec, des mesures effectuées lorsque le vent vient des régions inhabitées ont donné une concentration moyenne annuelleannuelle de 60 µg/m3 avec des valeurs fréquentes supérieures à 100 µg. La concentration en O3 augmente avec l'altitude. A l'observatoire de la Jungfrau, dans les Alpes Suisses, à 3 500 m d'altitude, on a mesuré des concentrations moyennes de 200 µg d'O3 par m3 avec des pointes à 400 µg/m3. A cette altitude, le rayonnement solairerayonnement solaire est particulièrement efficace et il est aussi vraisemblable qu'une partie de l'ozone provient de la stratosphère.
En France, au 45ème parallèle (ce qui correspond à la latitudelatitude de Bordeaux) la concentration naturelle varie, selon les auteurs, en moyenne annuelle de 60 à 80 µg d'O3 par m3, avec une moyenne de 25 µg en hiverhiver et de 100 µg en été.
Ces concentrations en ozone sont nettement plus élevées qu'en milieu urbain. Nous avons calculé les concentrations moyennes en ozone, pendant plusieurs années, dans 5 à 9 sites ruraux et autant de sites urbains. Les résultats sont indiqués dans le tableau n°5 :
Tableau n°5 :
Comparaison des concentrations moyennes en ozone entre sites ruraux et sites urbains :
| Concentrations en ozone en µg par m3 d'air | ||||
| Années | Moyennes annuelles | Percentiles 98 (**) | ||
| Sites ruraux | Sites urbains | Sites ruraux | Sites urbains | |
| 1990 | 55 | 29,7 | 131 | 76 |
| 1991 | 55,1 | 21 | 134 | 77 |
| 1992 | 62,5 | 16 | 133 | 88 |
| Moyennes | 57,5 | 22,2 | 132,7 | 80,3 |
L'analyse statistique de ces résultats donne une valeur de P comprise entre 0,05 et 0,01, ce qui signifie que les différences observées sont significatives selon une probabilité supérieure à 95 %. Autrement dit, il n'y a que 5 chances sur 100 que la concentration en O3 en milieu urbain soit supérieure à la concentration en milieu rural, aussi bien pour les moyennes annuelles que pour les percentiles 98.
Ces données montrent bien que la pollution par l'ozone n'est pas un fait nouveau qui serait créé par l'automobile contrairement à l'idée répandue par les médias, télévision, journaux et revues à grand tirage et aussi, plus surprenant, par un ouvrage aussi sérieux que Encyclopédia Universalis où l'on peut lire9 : « avec l'accroissement de la circulation automobile, une nouvelle pollution est apparue, celle que provoque l'ozone troposphérique. »
Certes, l'automobile est responsable d'émettre bien des polluants mais l'ozone est mal choisi pour caractériser la pollution produite par les automobiles et ce n'est pas en se trompant de cible que l'on pourra améliorer l'atmosphère des villes.
(*) hν (lettre grecque ν) est l'énergieénergie de la radiation solaire. Dans cette expression ν est la fréquencefréquence de la radiation et h la constante de la théorie quantique, ou constante de planckconstante de planck qui a pour valeur 6,6. 10-27 ergerg.seconde ou 6,6. 10-34 joulejoule seconde
(**) Le percentile 98 est la moyenne des concentrations horaires les plus fortes pendant 2 % du temps soit pendant les 175 heures les plus polluées dans l'année
9 Rogers Cans. Environnement : la pollution urbaine Encyclopédia Universaslis 1996 page 202