C'est l'aboutissement d'une dizaine d'années de recherches sur les implants électriques stimulant la moelle épinière qui permet, aujourd'hui, à trois paraplégiques de pouvoir marcher. Grâce à des électrodes plus fines et plus longues mais aussi avec l'appui de l'Intelligence artificielle, les neurotechnologies se synchronisent mieux. Dans un futur proche, avec un simple smartphone, les personnes paraplégiques pourront déclencher les stimulations qui activeront leurs muscles et leur permettront de marcher.
au sommaire
Ils ne pouvaient plus bouger leurs jambes, pas même les sentir. Plusieurs patients paraplégiques sont désormais capables de marcher à nouveau grâce à un implant qui stimule électriquement leur moelle épinière, une avancée qui pourrait se généraliser d'ici à quelques années. Cette technologie a permis à trois paraplégiques « de se tenir à nouveau debout, de se remettre à marcher, faire du vélo et nager », résume une étude parue lundi dans la revue Nature Medicine.
Ces trois patients, tous des hommes, étaient non seulement incapables de tout mouvementmouvement des jambes, mais ils n'y avaient plus la moindre sensation, à la suite d'accidents qui avaient endommagé leur moelle épinière. La moelle épinière, contenue par la colonne vertébrale, prolonge le cerveau et commande de nombreux mouvements. Ces derniers peuvent donc être irrémédiablement perdus si le contact avec le cerveau est abîmé.
Mais, pour ces trois patients, il a été possible de changer la donne. À Lausanne, une équipe, menée par la chirurgienne suisse Jocelyne Bloch et le neuroscientifique français Grégoire Courtine, leur a implanté une quinzaine d'électrodesélectrodes qui permettent de stimuler électriquement plusieurs zones de leur moelle épinière.
Ce n'est pas une première, mais plutôt l'aboutissement de dix ans de travaux de ce type avec, enfin, la perspective d'en faire une thérapiethérapie qui changerait la vie de nombreux paralytiques. L'idée d'envoyer un courant électrique pour retrouver des mouvements perdus remonte à plusieurs décennies et a été mise en pratique pour la première fois en 2011. Un paraplégique avait alors été capable de se tenir à nouveau debout.
Plusieurs patients paraplégiques sont désormais capables de marcher à nouveau grâce à un implant qui stimule électriquement leur moelle épinière. © EPFL
Et faire ses premiers pas… durant un kilomètre
En 2018, plusieurs équipes, dont déjà celle de Mme Bloch et M. Courtine, avaient réussi à faire remarcher des patients à l'aide d'une telle technologie. Mais on était encore loin de pouvoir envisager une applicationapplication concrète. Les patients concernés avaient eu besoin de plusieurs semaines pour refaire quelques pas et leurs progrès restaient limités, sans guère pouvoir bénéficier à leur vie quotidienne. Cette fois, les patients opérés ont pu faire leurs premiers pas presque immédiatement même si, réalisés sur un tapis roulanttapis roulant en laboratoire, ils n'avaient rien à voir avec une marche normale.
“L'un des patients était par exemple en mesure de marcher près d'un kilomètre sans interruption”
« Il ne faut pas imaginer un miracle immédiat [mais] cela permet de s'exercer tout de suite à ses activités », a expliqué M. Courtine lors d'une conférence de presse. Après cinq mois de rééducation, les progrès étaient considérables : l'un des patients était par exemple en mesure de marcher près d'un kilomètre sans interruption.
Pour parvenir à de telles avancées, les chercheurs ont amélioré la technologie utilisée par rapport aux précédentes expériences. Celles-ci se basaient sur des outils préexistants de stimulationstimulation électrique. Or ces dispositifs étaient conçus dans un but différent : réduire la douleurdouleur et non relancer des mouvements, un objectif bien plus complexe d'autant que chaque être humain possède une moelle épinière aux caractéristiques très variables.
Des impulsions électriques plus précises grâce à l'Intelligence artificielle
Cette fois, « les électrodes sont plus longues et plus grandes que celles utilisées auparavant, ce qui permet d'accéder à plus de muscles », a détaillé Jocelyne Bloch. Autre avancée importante, grâce à des logicielslogiciels utilisant l'intelligence artificielleintelligence artificielle, les impulsions électriques sont bien plus précises : elles correspondent mieux à chaque mouvement, au lieu de consister en un flux de courant indiscriminé.
Quand ces avancées pourront-elles bénéficier au plus grand nombre ? « Avec un peu de chance, d'ici à quelques années », estime Mme Bloch. La technologie doit faire l'objet d'essais cliniquesessais cliniques bien plus larges sous l'égide d'une start-upstart-up néerlandaise, Onward. Cette société vise à la rendre facilement utilisable à l'aide d'un smartphone, par exemple pour contrôler son déclenchement.
Car c'est une des limites à prendre en compte : dès qu'elle est éteinte, la stimulation électrique n'a quasiment pas d'effet durable. Et il est inconcevable de la maintenir en permanence, ce qui épuiserait l'organisme des patients. Mais retrouver un peu de mouvement chaque jour, c'est déjà beaucoup, comme en témoigne l'un des patients, Michel Roccati, chez qui ces électrodes ont été implantées en 2020, trois ans après un grave accident de motomoto. « Je l'utilise tous les jours pendant quelques heures : au travail, chez moi, pour pas mal de choses, a-t-il raconté. Maintenant, ça fait partie de mon quotidien ».
Neuroprothèse : des singes paralysés remarchent grâce à un implant dans le cerveau (MAJ)
Article de l'Inserm, publié le 10 novembre 2016
Une interface cerveau-moelle épinière permet à un singe qui a eu une lésion de la moelle épinière de retrouver l'usage d'un membre inférieur paralysé. Cette neuroprothèse qui court-circuite la lésion est également testée chez l'Homme dans un essai clinique à l'hôpital universitaire de Lausanne.
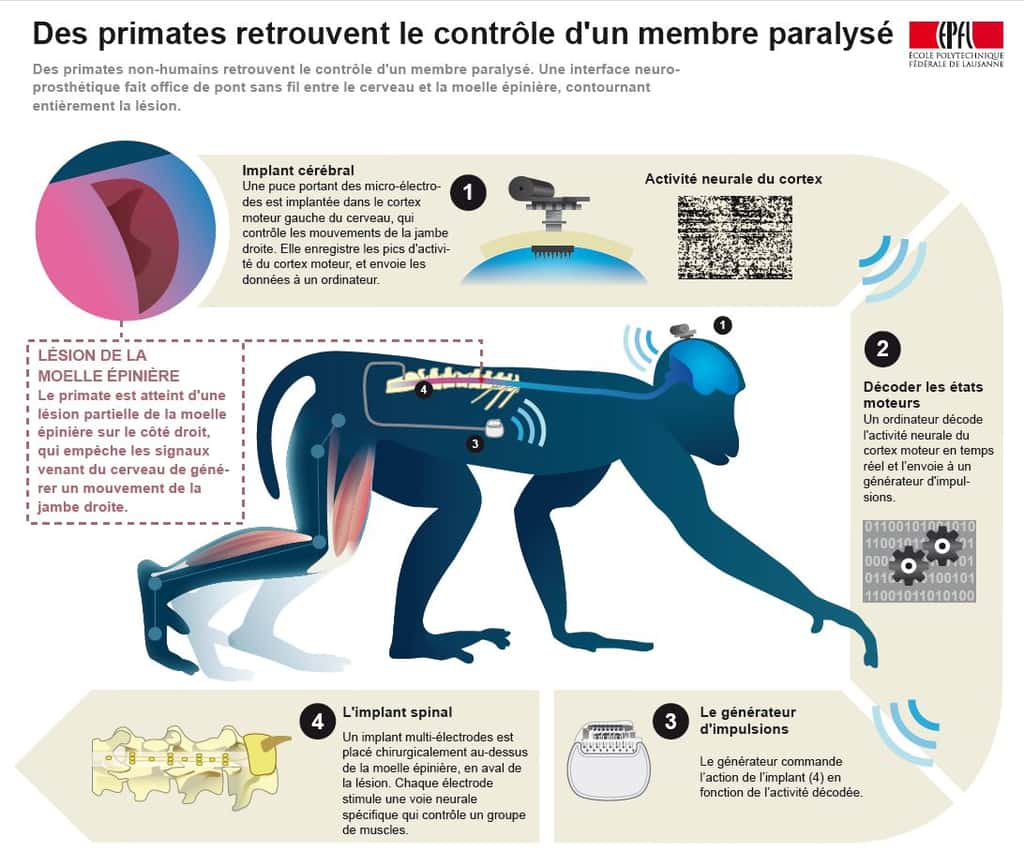
Le 23 juin 2015, un premier singe macaque porteur d'une lésion de la moelle épinière a pu retrouver le contrôle d'un membre inférieur paralysé, et donc remarcher, grâce à une neuroprothèse appelée « interface cerveau-machine » court-circuitant la lésion. Ce système est capable de restaurer la communication entre le cerveau (lieu de genèse des actions volontaires) et la région de la moelle épinière produisant les mouvements des membres inférieurs.
Cette interface cerveau-machine enregistre l'activité cérébrale liée à l'intention de marche, la décode, et transmet cette information à la moelle épinière sous la lésion. Cette transmission est assurée par des électrodes qui stimulent les réseaux nerveux activant les muscles des jambes pendant la locomotion naturelle. Ainsi, seuls les mouvements souhaités par le singe sont produits.
Cette neuroprothèse a été conçue à l'EPFL (Lausanne, Suisse) et techniquement développée par un groupe international composé de Medtronic (États-Unis), l'université Brown (États-Unis) et le Fraunhofer ICT-IMM (Mayence, Allemagne). Elle a ensuite été testée chez le primateprimate en collaboration avec l'Inserm, le CNRS, l'université de Bordeaux et le centre hospitalier universitaire de Lausanne (Suisse).
Les résultats ont été publiés le 9 novembre 2016 dans la revue Nature. « C'est la première fois qu'une neuroprothèse restaure la marche chez le primate », déclare Grégoire Courtine, professeur à l'EPFL, qui conduit le consortium. « Les deux singes ont été capables de remarcher immédiatement après la mise en fonction de la neuroprothèse. Aucun entraînement n'a été nécessaire », indique Erwan Bézard, directeur de recherches Inserm et directeur de l'institut des Maladies neurodégénérativesMaladies neurodégénératives (CNRS/université de Bordeaux), qui a supervisé les expériences sur le primate menées dans son centre. « Il faut toutefois conserver à l'esprit les nombreux challenges qu'il reste à relever. Même si les essais cliniques débutent, cela prendra quelques années avant que de telles approches soient disponibles en clinique pour l'Homme. »
L’interface cerveau-moelle testée chez des patients en Suisse
Dans le système nerveux intact, le signal électrique produisant la marche est généré au niveau des neuronesneurones cérébraux du cortex moteurcortex moteur. Ces signaux sont aussitôt envoyés à la région lombaire de la moelle épinière. À ce niveau, des réseaux complexes de neurones prennent le relais et contrôlent l'activation des muscles des jambes responsables de la marche. Des faisceaux de fibres nerveusesfibres nerveuses provenant du cerveau fournissent l'information requise à ces neurones quant à l'intention (ou non) de marcher, leur permettant alors de s'activer pour la réalisation du comportement. Une stimulation électrique délivrée précisément est donc capable de moduler ces réseaux et de produire l'activation désirée des muscles des jambes.
Le professeur Jocelyne Bloch, neurochirurgienne, du centre hospitalier universitaire de Lausanne (CHUV) conduit maintenant l'essai clinique qui permettra d'évaluer, chez l'Homme, le potentiel thérapeutique de cette technologie qui permettrait à des patients avec des lésions incomplètes de la moelle épinière de remarcher.
L'interface est composée d'un implant cérébral, d'un système d'enregistrement, d'un ordinateurordinateur, d'un stimulateur implantable et d'un implant spinal. L'implant cérébral est une puce comparable à celles déjà utilisées chez l'Homme pour des recherches sur les interfaces cerveau-ordinateur, et placée chirurgicalement sur le cortex moteur. Développé à l'université Brown en collaboration avec les docteurs Borton et Nurmikko, le système d'enregistrement est connecté à l'implant cérébral pour enregistrer l'activité électrique et relayer celle-ci en temps réel et sans fil à un ordinateur. L'ordinateur décode l'activité électrique cérébrale, grâce à des algorithmes spécifiquement développés pour détecter le souhait du singe d'effectuer tel ou tel mouvement en temps réel. Cette « intention » de se mouvoir est transformée en protocoleprotocole de stimulation de la moelle épinière qui est transmis, là encore sans fil, au stimulateur spinal implantable.
Le stimulateur spinal implantable est du type de ceux communément utilisés pour la stimulation cérébrale profonde (exemples : maladie de Parkinsonmaladie de Parkinson, tremblement essentiel). Tim Denison et son équipe (Medtronic Inc.)) ont développé un nouveau petit logiciel incorporé dans le stimulateur pour recevoir les informations en temps réel. Le stimulateur spinal implantable reçoit le protocole de stimulation sans fil et délivre les instructions de stimulation via l'implant spinal. L'implant spinal est composé de 16 électrodes préalablement placées chirurgicalement à des endroits précis sur la partie dorsale de la moelle épinière lombaire. Cet implant spinal active de manière synergique les groupes de muscles de la jambe paralysée, permettant la production des mouvements de flexionflexion et d'extension nécessaires à la marche.
----------
Une neuroprothèse soigne une paralysie des mains chez des singes
Article initial de Janlou ChaputJanlou Chaput, paru le 22/04/2012
Des singes paralysés de la main et du poignet ont retrouvé 80 % de leur dextérité grâce à une nouvelle neuroprothèse, commandée par le cerveau lui-même. Les chercheurs soutiennent l'idée que la technologie pourrait très vite être appliquée à l'Homme, même si quelques obstacles restent à franchir.
Pour produire un mouvement, le cortex moteur primaire du cerveau envoie un influx nerveuxinflux nerveux qui se propage le long de la moelle épinière, emprunte ensuite un nerfnerf et se termine au niveau du muscle, lequel répond alors à l'injonction. Malheureusement, parfois, cette communication est coupée en un point et il devient impossible de produire un mouvement : c'est la paralysie.
Les scientifiques essaient de contourner le problème en mettant au point des procédés ingénieux. Parmi eux, un système permet d'ouvrir ou de fermer la main en fonction des mouvements de l'épaule, traduits en signaux électriques et envoyés jusqu'aux muscles.
Mais cela n'est pas naturel. Des chercheurs, comme ceux de la Northwertern University de Chicago, pensent qu'on peut nettement affiner les réglages. Ils viennent de tester avec succès chez le singe une nouvelle neuroprothèse capable de recréer un mouvement manuel directement à partir des informations nerveuses émanant du cerveau.

La paralysie disparaît presque quand la neuroprothèse est activée
L'expérience, publiée dans Nature, s'est déroulée en plusieurs temps. D'abord, il a fallu placer une grille d'électrodes au niveau des neurones du cortex moteur primaire du cerveau de deux macaques rhésusmacaques rhésus (Macaca mulatta), plus précisément dans la région en charge de la mobilité de la main. Ensuite, cinq électrodes ont été placées sur trois muscles du bras utilisés dans la préhension.
Grâce à ce dispositif, ils ont pu enregistrer simultanément l'activité électronique qui provenait des différentes électrodes lorsque l'un des deux sujets se saisissait d'un objet. À partir de ces données, des algorithmes de codagecodage informatisés ont été mis au point, capables de prédire comment un signal cérébral va être traduit au niveau musculaire. Plus simplement : en voyant quels neurones s'activent, ils peuvent déterminer quels muscles vont être contractés ou relâchés. Il est alors possible de stimuler les muscles comme il convient.
Cette vidéo démontre l'efficacité de la neuroprothèse. Le macaque ne parvient plus à saisir la balle lorsqu'elle est désactivée. Il suffit de la mettre sur « on » pour que le singe retrouve la plus grande partie de sa dextérité. © Miller et al., Nature
Pour vérifier la pertinence de leurs calculs, la technique a été testée in vivoin vivo, sur les deux singes. En leur injectant une moléculemolécule qui bloque la communication nerveuse, les chercheurs ont paralysé temporairement leurs deux animaux au niveau du poignet et de la main. Les singes ne parvenaient plus à réussir une action qu'ils réalisaient aisément auparavant, en l'occurrence placer une balle dans un tube et obtenir en récompense du jus de fruit.
Lorsque la neuroprothèse a été activée, la dextérité des singes s'est étonnamment accrue, et leur taux de réussite à ce petit jeu est monté à environ 80 %. Les scientifiques sont donc parvenus à restaurer de la mobilité en décryptant les intentions directement dans le cerveau.
Un procédé réellement applicable tel quel chez l’Homme ?
Pour les auteurs, cet aspect rend l'étude particulièrement intéressante, car elle permet de revenir aux fondamentaux : c'est la pensée qui contrôle le mouvement. Plus besoin donc de contourner le problème en esquissant un haussement d'épaule non naturel pour se saisir d'un objet. De plus, Lee Miller, qui a chapeauté cette étude, pense que le travail est assez facilement extrapolable à l'Homme. Cependant, il faudra du temps avant d'obtenir l'aval des autorités sanitaires pour tester le produit, et pour recruter des volontaires. Mais il espère avoir réuni toutes les conditions d'ici quelques années.
Tout le monde ne partage pas cet optimisme. Car la paralysie du bras, telle qu'elle existe chez l'Homme en cas de lésions à la moelle épinière, est plus complexe que ce qui est présenté ici. Davantage de muscles sont touchés, donc l'analyse des données sera plus complexe, et la coordination devra être très bien orchestrée. Cela n'effraie pas Miller pour autant, qui pense déjà améliorer son procédé en allant stimuler les nerfs contrôlant les muscles plutôt qu'en agissant au niveau des muscles eux-mêmes.
























