La première respiration d'un nouveau-né est à la fois un moment rempli d'émotion et crucial pour sa survie. Des chercheurs américains ont mis en évidence l'implication d'un gène, qui contrôle la respiration autonome, qui s'exprime pile au moment où bébé pousse son premier cri.
au sommaire
Nous respirons en toutes circonstances, consciemment ou non. Il est impossible de se rappeler de sa première respiration, seules les mères qui entendent alors pour la première fois la voix de leur bébé s'en souviennent. C'est pourtant un moment crucial de la vie, celui où les poumons reçoivent pour la première fois de l'airair après la vie intra-utérine.
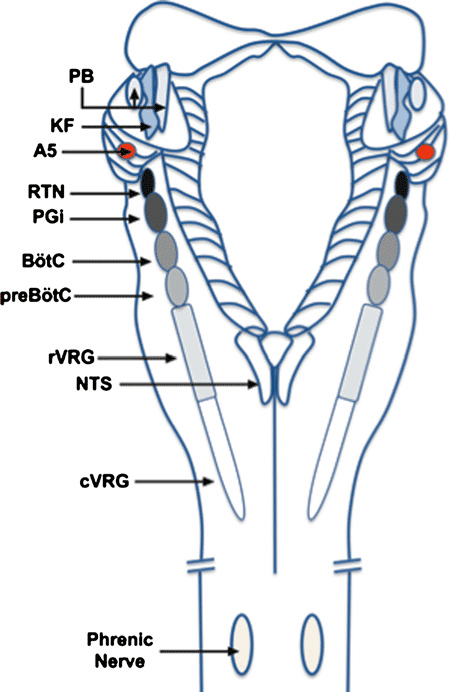
Ce réflexe respiratoire est assuré par plusieurs types de neurones respiratoires. Parmi ceux-là, il y a un groupe de neurones, situé dans le noyau rétro-trapézoïde dans le tronc cérébral, qui contrôle la pressionpression partielle artérielle en CO2 et en hydrogènehydrogène, selon un mécanisme appelé chémoréflexe respiratoire central au CO2, et génère le rythme respiratoire.
Une anomalie dans la respiration autonome est à l'origine d'une maladie génétique rare, le syndrome d’Ondine, dans lequel une mutation du gènegène Phox2B, exprimé dans les neurones du noyau rétro-trapézoïde, induit une ventilationventilation trop faible des alvéoles pulmonairesalvéoles pulmonaires.
Dans une publication parue dans Nature, des chercheurs américains ont réalisé plusieurs expériences sur des souris pour étudier l'implication d'un autre gène exprimé dans les neurones du noyau rétro-trapézoïde, Pacap, qui code pour un neurotransmetteurneurotransmetteur sécrété au moment où le nouveau-né prend sa première respiration. Sans lui, la respiration est troublée et les souris présentent les symptômessymptômes de la mort subitemort subite du nourrisson.
Un gène impliqué dans la mort subite du nourrisson ?
Le gène Pacap (pituitary adenylate cyclase-activating polypeptidepolypeptide)) code pour un neuropeptide du même nom composé de 176 acides aminésacides aminés, il est situé sur le chromosomechromosome 18. Lorsque les médecins américains ont altéré ce gène, ils ont observé que les souriceaux venant de naître avaient quatre fois plus de risque de faire des apnées que les autres. Ces pauses dans la respiration sont potentiellement dangereuses pour les nouveau-nés. Les chercheurs ont également mis en évidence que ces troubles s'aggravent en fonction de la température. À 30 °C, la fréquence des apnéesapnées est trois fois supérieure chez les souris sans le gène Pacap que chez les souris normales.
Leur chémoréflexe respiratoire central au CO2 était aussi largement diminué, d'environ 50 % par rapport aux souriceaux n'ayant pas subi la modification génétique. Les scientifiques ont observé ces troubles de la respiration qui ne sont pas dus à l'absence du neuropeptide Pacap, mais à une diminution de l'expression de son récepteur, PAC1. Lorsque Pacap n'est plus fonctionnel, seul 5 % des neurones du noyau rétro-trapézoïde expriment PAC1.
Un gène Pacap dysfonctionnel n'est pas létallétal pour les souriceaux, mais augmente leur risque de mort subite. En effet, chez les nouveau-nés, il a été observé qu'une altération de ce gène est liée à un risque accru de mort subite du nourrisson. Combiné à des facteurs environnementaux, un chémoréflexe respiratoire anormal peut être létal. Mais grâce à une prise en charge médicale, les bébés atteints du syndromesyndrome d'Ondine peuvent vivre une vie quasi-normale.
Identification dans le cerveau d'une molécule essentielle à l'automatisme respiratoire
Article publié le 3 janvier 2003 par l'Inserm
Deux équipes marseillaises coordonnées par Michael Sieweke et Gérard Hilaire (directeurs de recherche au CNRS) -Centre d'immunologie de Marseille-Luminy (CNRS-INSERM-Université de Méditerranée) et Groupe d'étude des réseaux moteurs (CNRS-Université de Méditerranée)- viennent de montrer que, chez la souris, l'absence d'une moléculemolécule appelée MafB conduit à la perte de certains neurones dans le cerveaucerveau au cours du développement embryonnaire. Cela entraîne une forte diminution du rythme respiratoire à la naissance et aboutit à la mort par arrêt respiratoire (apnée) du nouveau-né.
MafB semble donc jouer un rôle clé dans le contrôle central de la respiration et dans la mise en place des neurones indispensables à l'automatisme respiratoire. Ces travaux pourraient permettre de mieux cerner, chez l'homme, les mécanismes des apnées du sommeilapnées du sommeil et de syndrome de mort subite du nourrissonsyndrome de mort subite du nourrisson. Ils font l'objet d'un article publié dans la revue Nature Neuroscience du mois d'octobre.
Le réseau neuronalréseau neuronal qui, dans le cerveau, engendre les impulsions rythmiques à l'origine des mouvementsmouvements respiratoires, suscite depuis longtemps l'intérêt des chercheurs et savants. Déjà AristoteAristote (384-322 av J.C.) s'interrogeait dans " De respiratione " sur le mécanisme de la respiration. La respiration réflexe est un des processus physiologiques essentiels à la vie chez tous les mammifèresmammifères. Il suffit de retenir quelques secondes sa respiration pour prendre conscience de l'automatisme des mouvements des muscles qui, plus de 14 000 fois par jour, sans que l'on ait besoin d'y penser, font bouger notre cage thoraciquecage thoracique et notre diaphragmediaphragme et ainsi provoquent inspiration et expiration. Or des défauts dans le contrôle central de ces mouvements respiratoires sont à l'origine de troubles respiratoires invalidants allant des apnées du sommeil au syndrome de mort subite du nourrisson (MSN), principale cause de mortalité des nouveau-nés dans les pays occidentaux.
Depuis une centaine d'années, on sait que le " centre " de commande qui génère les impulsions rythmant ces mouvements respiratoires automatiques se trouve dans le tronc cérébral. Récemment, des études physiologiques ont permis de mieux cerner les zones concernées : l'une d'elles se situe dans une région appelée le complexe préBötzinger.
Les travaux des équipes marseillaises montrent aujourd'hui que le facteur de transcriptiontranscription MafB est exprimé dans ce complexe préBötzinger et qu'il joue un rôle clé dans le développement de certains neurones de cette région. Si l'on ne connaît pas encore les gènes précis sur lesquels MafB agit, l'absence de la molécule a des effets reconnus : des nouveau-nés de souris, chez lesquels on empêche dès le début du développement embryonnaire la production de MafB , meurent à la naissance, suite à de graves problèmes respiratoires. Le complexe préBötzinger de ces nouveau-nés n'est pas correctement formé : il manque un nombre important de neurones critiques et le réseau nerveux respiratoire n'arrive pas à déclencher les impulsions rythmiques.
Vers une meilleure connaissance de l'origine des apnées du sommeil
Les auteurs de cette étude démontrent que MafB, par l'intermédiaire des gènes qu'il contrôle, est essentiel à la détermination de l'identité des neurones générateursgénérateurs du rythme respiratoire.
Ces résultats non seulement apportent les premiers éléments d'informations sur la génétique d'un petit ensemble de neurones vitaux, mais ils ouvrent aussi de nouvelles voies de recherche pour identifier les personnes susceptibles de développer des apnées graves pendant leur sommeil ou les enfants présentant des risques de mort subite du nourrisson.
Les chercheurs vont maintenant essayer de déterminer quels sont les gènes sur lesquels MafB agit durant le développement des neurones contrôlant le rythme respiratoire.