au sommaire
1 - Réactivité de la couche d’alumine
L'alumine est un produit ionique non hydratable, irréductible par voie chimique. La bauxitebauxite est le seul cas d'alumine hydratée. Par déshydratationdéshydratation de la bauxite on obtient :
--- soit de l'alumine alpha - le corindon - de structure compacte et très réfractaireréfractaire, son PF est supérieur à 2000 degrés Celsius et on peut y fondre pratiquement n'importe quel métal. Cette alumine avec quelques impuretés n'est rien d'autre que le saphir si c'est du fer II ou du titane,

Cristaux de corindon var, saphir, cristaux de microcline var. amazonite, cristaux de biotite. © Parent Géry, wikimedia commons, 3.0
ou le rubis avec des traces de chrome,

ou l'améthyste orientale avec du manganèsemanganèse III.
--- soit l'alumine gamma, qui vers 800 degré, s'organise en alumine alpha, et dont la structure est désorganisée. C'est un absorbant puissant utilisé comme catalyseurcatalyseur de déshydratation et en chromatographiechromatographie.
La bonne résistancerésistance de l'aluminiumaluminium à la corrosioncorrosion est due à la capacité de sa surface à devenir passive. Ceci est lié à une réaction rapide de l'aluminium avec l'oxygèneoxygène de l'environnement qui permet de créer une couche d'oxyde fine et amorpheamorphe formée par l'airair (couche d'alumine, de 1-10 nm) qui protège le métal. Pour les surfaces lisses, l'aluminium serait protégé, dans l'idéal, par une couche d'oxyde continue.
Au contact de l'humidité de l'environnement ou lors d'une immersion dans l'eau bouillante, la surface externe de la couche d'alumine est hydratée. La perte d'aluminium transformée en produits de corrosion est faible. L'immersion de l'aluminium dans l'eau bouillante est appelé boehmitage (formation de boehmite Al2O3.H2O) et est utilisée industriellement pour améliorer les propriétés de l'aluminium contre la corrosion.

La couche d'alumine se dissout lors d'un contact avec des acidesacides (fluorhydrique ou phosphorique )) ou des alcalis (NaOH). De ce fait, une corrosion rapide de l'aluminium a lieu en raison de l'absence de l'alumine. Mais la couche d'oxyde ne se dissout pas dans un acide nitrique concentré (HNO3). En effet cet acide a un potentiel redox élevé qui favorise la passivation de l'alumine.
2 - Le comportement de l'aluminium à la corrosion
Il dépend des propriétés de surface et des couches qui sont à proximité.
Malheureusement, les surfaces d'aluminium ne sont pas parfaites.
- Défauts créés lors de la fabrication ou de la manipulation tels que : rayures, macro-rugosité (ex : traces de laminagelaminage), calamine ou lubrifiantslubrifiants
- Défauts liés à la microstructure tels que : joints de grains intermétalliques
La surface occupée par de tels défauts est faible 0,2% de la surface est touchée ; mais elle est importante pour les performances contre la corrosion et la duréedurée de vie. Le comportement physiquephysique, chimique et électrochimique de tels défauts est différent de celui de la surface macroscopique de l'aluminium.
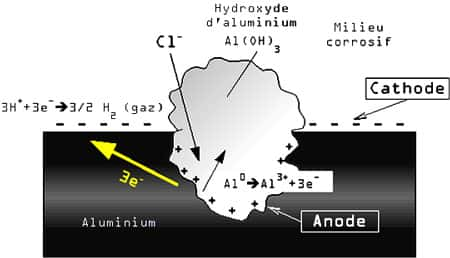
A - La corrosion galvanique
C'est une corrosion localisée qui se produit chaque fois que deux métauxmétaux ou alliagesalliages ayant une différence de potentiel d'au moins 50 mV se retrouvent en contact direct et avec un électrolyte corrosif. Le moins noble des deux métaux ou alliages fera office d'anodeanode pendant la réaction de corrosion.
Dans cet exemple, l'aluminium est le moins noble des deux métaux, et par conséquent, il deviendra l'anode de la réaction de corrosion.
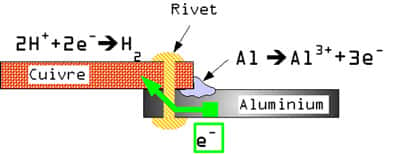
-- Corrosion galvaniqueCorrosion galvanique aluminium cuivrecuivre
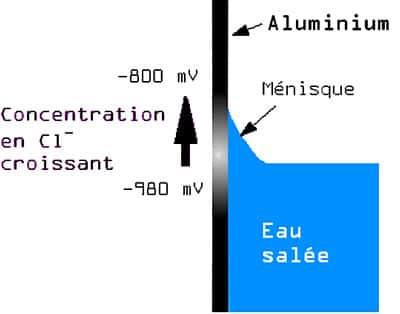
-- Corrosion de l'aluminium à l'eau salée
B - La corrosion par piqûre
C'est une autre forme de corrosion localisée. La corrosion se produit localement formant des points à la surface du métal, mais ces piqûres peuvent se développer rapidement et finir par perforer la structure. Le nombre de piqûres dépend de l'alliage : par exemple, pour un alliage contenant 4% de cuivre, le nombre de piqûres est de l'ordre de 1000 par cm2.

Les alliages dans lequel Cu est l'élément d'alliage principal sont particulièrement prédisposés à la corrosion par piqûre.