À l'aide d'un broyeur à billes, des chercheurs ont créé une forme de glace amorphe jamais vue jusqu'à aujourd'hui. Avec une densité proche de celle de l'eau liquide, elle serait peut-être sa forme vitreuse, et possède des propriétés étonnantes…
au sommaire
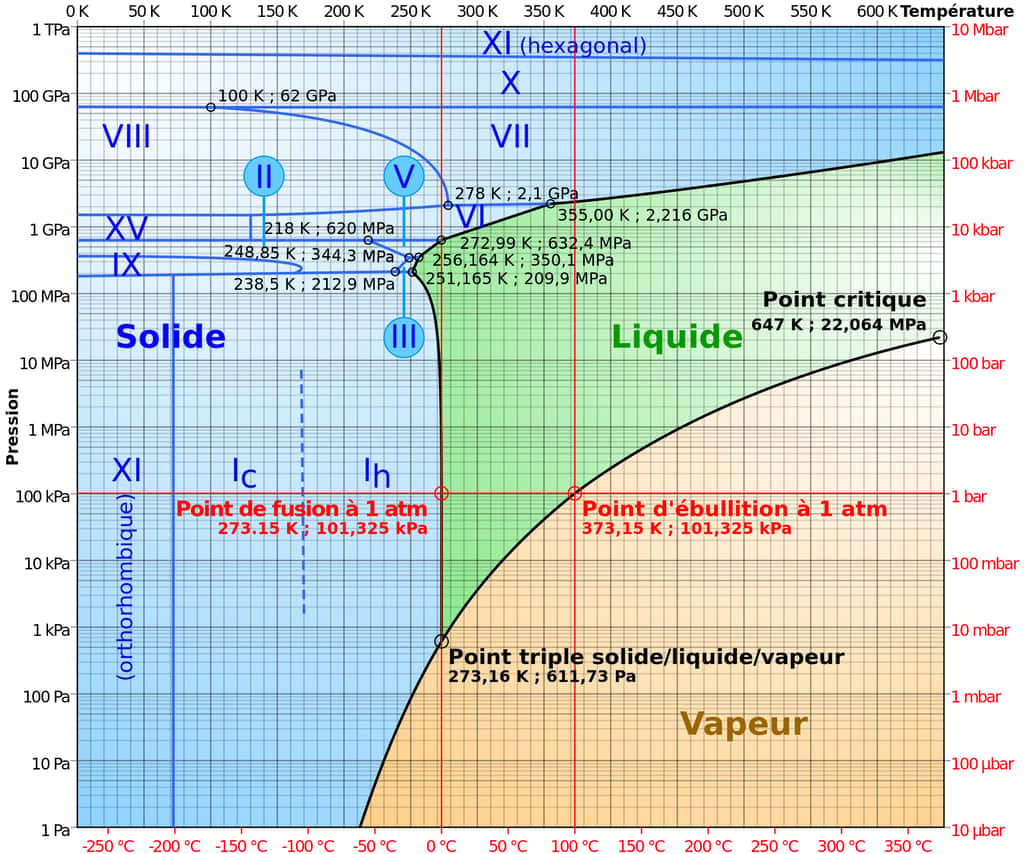
On ne le croirait pas, mais l'eau est une substance chimique encore très mal comprise, et étrange. C'est tout d'abord l'une des seules à être moins dense sous forme solide que liquide. Car, le plus souvent, lorsqu'un matériau se solidifie, les molécules se rapprochent les unes des autres, donc il se densifie. Pour l'eau, c'est l'inverse ! Une autre propriété curieuse est sa capacité à geler plus vite lorsque l'eau est chaude que lorsque l'eau est froide, ou à dissoudre un grand nombre d'autres substances ! Elle existe de plus sous près de 20 formes cristallinesformes cristallines différentes, explique une étude récente publiée dans Science. L'un des auteurs, le professeur Christoph Salzmann du département de chimie de la University College London (UCL) a déclaré dans un communiqué : « L'eau est le fondement de toute vie. Notre existence en dépend, nous lançons des missions spatiales à sa recherche, pourtant d'un point de vue scientifique, elle est mal connue. »
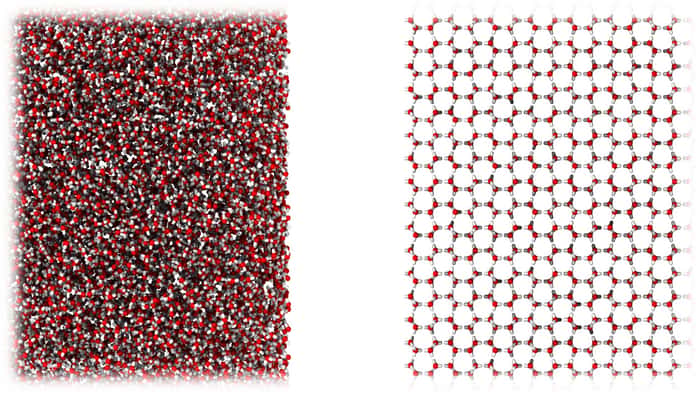
L'étude se concentre sur un état particulier de l'eau, la glace amorpheamorphe. Car celle que l'on rencontre sur Terre, dans les glaciers notamment, se trouve sous forme cristalline : les molécules d'eau s'organisent dans une structure hexagonale. Dans la glace amorphe, c'est tout l'inverse : on ne peut observer aucune structure à grande échelle, les molécules ne possèdent aucun arrangement précis. Jusqu'à présent, deux types de glace amorphe ont été créés en laboratoire. Une forme à haute densité, et une forme à basse densité. Aujourd'hui, les chercheurs rapportent un troisième type de glace amorphe, qui pourrait bien expliquer certaines propriétés de l'eau : la glace amorphe à densité moyenne, ou MDA.
« Une sorte d'eau en stop-motion »
Découverte en 1930 sous sa forme à faible densité alors que des chercheurs ont condensé de la vapeur d'eau sur une surface métallique à 120 KelvinKelvin (environ -150 °C), la glace amorphe se répartit historiquement en deux familles : à faible et haute densité. La deuxième a été découverte lorsque de la glace naturelle a été comprimée, sous une température de 77 K (environ -200 °C) obtenue grâce à de l'azoteazote liquide. Leurs densités se situent autour de 0,94 g/cm3 et 1,13 g/cm3, soit autour de celle de l'eau liquide, à 1g/cm3. Si bien qu'il était communément admis qu'aucune glace amorphe ne pouvait se trouver entre ces deux formes.
C'est bien ce qui a surpris les physiciensphysiciens lorsqu'ils ont effectué un broyage à billes sur de la glace ordinaire, le tout dans un environnement à 77 Kelvins. Cette technique utilisée dans plusieurs industries n'avait encore jamais été utilisée sur de la glace. Elle consiste à mélanger dans un bocal en acieracier des billes de métalmétal avec de la glace, puis à faire tourner le tout très vite. « Nous avons secoué la glace comme des fous pendant longtemps et détruit la structure cristalline. Plutôt que de se retrouver avec de plus petits morceaux de glace, nous avons réalisé que nous avions trouvé un tout nouveau genre de chose, avec des propriétés remarquables », a commenté le Dr Alexander Rosu-Finsen, premier auteur de l'étude et chercheur à l'UCL.
En effet, lorsqu'ils ont calculé sa densité à partir de sa flottabilitéflottabilité dans l'azote liquide, ils ont obtenu un résultat de 1,06 ± 0,06 g/cm3, soit une densité très proche de celle de l'eau liquide ! « Nous avons montré qu'il est possible de créer ce qui ressemble à une sorte d'eau en stop-motion. C'est une découverte inattendue et assez étonnante », s'est enthousiasmée Andrea Sella, coauteure de l'étude et professeure à l'UCL. « Notre étude montre que la densité de la MDA se situe précisément dans cet écart de densité et cette découverte peut avoir des conséquences considérables pour notre compréhension de l'eau liquide et de ses nombreuses anomaliesanomalies », a renchéri C.Salzmann.
Un état vitreux de l'eau ?
Pour en savoir plus sur cette nouvelle forme d'eau, les chercheurs ont effectué de nombreuses analyses par spectroscopie et diffractiondiffraction des rayons X, le tout leur permettant ensuite de reproduire la structure atomique par des simulations numériquessimulations numériques. De nombreuses similitudes structurelles avec l'eau liquide sont apparues ! « Notre découverte de la MDA soulève de nombreuses questions sur la nature même de l'eau liquide et il est donc très important de comprendre la structure atomique précise de MDA, commente dans un communiqué le Dr Michael Davies, coauteur de l'étude et en charge de la modélisationmodélisation informatique. Nous avons trouvé des similitudes remarquables entre le MDA et l'eau liquide ».
Au point où ils se sont demandé si cette glace n'était pas un état vitreux de l'eau liquide ! Car les verresverres, qui constituent la majorité des matériaux amorphes, peuvent se former lorsqu'un liquide refroidit sans possibilité de cristalliser, mais aussi par broyage mécanique ! Une autre possibilité est cependant envisagée par les chercheurs. « Ces résultats soulèvent la possibilité que le MDA soit le véritable état vitreux de l'eau liquide ou alternativement un état cristallin fortement cisaillé », décrit l'étude. De futures études, mettant en perspective cette idée avec le fait que l'eau possède une transition liquide-liquide à basse température, seront nécessaires pour le savoir.

On pourrait trouver une glace similaire dans des mondes glacés
À part sur Terre, la glace amorphe représente la forme de glace la plus abondante dans l'Univers. Y compris dans les luneslunes glacées du Système solaireSystème solaire ! Celle-ci en particulier, à densité moyenne, pourrait être créée par les forces de cisaillement, elles-mêmes générées par les forces de maréeforces de marée qui règnent sur les satellites des planètes géantesplanètes géantes, comme JupiterJupiter ou SaturneSaturne. Or, une autre propriété de cette glace amorphe à densité moyenne a étonné les chercheurs : sa transition vers l'état cristallin. En la comprimant et en la chauffant, la glace amorphe a cristallisé, mais surtout a libéré une grande quantité de chaleurchaleur !
Selon les chercheurs, cela suggère que l'eau pourrait être « un matériau géophysique à haute énergieénergie », soit un moteur pour l'activation de mouvementsmouvements tectoniques sur ces lunes glacées. « On dit que la glace amorphe en général est la forme d'eau la plus abondante dans l'UniversUnivers. La course est maintenant lancée pour comprendre à quel point il s'agit de MDA et à quel point la MDA est géophysiquement active », a conclu le professeur Angelos Michaelides, coauteur de l'étude.
























