au sommaire
Attaques cérébrales : un grand pas vers de meilleurs traitements
A ce jour, il n'existe qu'un seul recours : la thrombolyse ou destruction du caillot sanguin qui obstrue une artère cérébrale, grâce à une moléculemolécule appelée tPA. L'équipe Avenir de l'Inserm « Activateur tissulaire du PlasminogèneActivateur tissulaire du Plasminogène (tPA) dans le fonctionnement cérébral » dirigée par Denis Vivien vient de montrer que cette molécule pouvait passer la barrière encéphalique avec des conséquences potentiellement graves sur la mémoire, l'apprentissage et la mort des neurones. Ces travaux publiés dans Circulation permettent d'envisager aujourd'hui des traitements des AVCAVC présentant moins d'effets secondaires sévères.
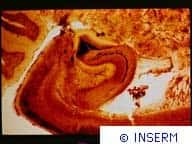
La plupart des accidents vasculaires cérébraux (AVC) sont dits ischémiquesischémiques : ils ont pour origine le blocage d'une artère cérébrale par un caillot de sangcaillot de sang, privant ainsi des parties entières du cerveau d'alimentation en oxygène et en glucoseglucose, ce qui aboutit à une mort neuronale massive. L'AVC ischémique entraîne une mortalité élevée, et chez les survivants le handicap reste souvent sévère.
Le traitement actuel consiste à lyser, c'est-à-dire à désagréger le caillot en vue de réalimenter le tissu cérébral. C'est le rôle de l'Activateur tissulaire du Plasminogène, ou tPA, molécule disponible depuis une dizaine d'années seulement. Cette protéaseprotéase a permis d'importants progrès dans la prise en charge des AVC ischémiques, puisqu'elle réduit la mortalité de manière significative.
Le tPA, une molécule à deux facettes
Jusqu'ici, les cliniciens s'accordaient à ne trouver que deux réels inconvénients au tPA. En premier lieu il induit un risque relativement élevé d'hémorragie. Ensuite, pour que le produit soit efficace, il est nécessaire de l'injecter dans les 3 heures qui suivent l'apparition des premiers symptômessymptômes. Une fenêtrefenêtre thérapeutique d'autant plus courte que le patient lui-même et son entourage peuvent mettre un certain temps avant de se rendre compte qu'il s'agit d'une urgence.
Malgré son intérêt thérapeutique indéniable des voix se sont élevées pour se demander si le tPA n'était pas également responsable d'effets néfastes sur le cerveau. Ainsi, par exemple, il a été montré que la lésion créée par l'AVC était en fait réduite chez les souris déficientes en tPA. Cette épineuse question est au centre des recherches conduites par l'équipe Avenir fondée début 2005 et dirigée par Denis Vivien.
« Grâce aux compétences en biologie moléculairebiologie moléculaire, cellulaire et en expérimentation animale réunies au sein de notre équipe, précise Denis Vivien, nous avons déjà pu montrer que le tPA peut être considéré comme un modulateur de la signalisation glutamatergique. Or les récepteurs au glutamateglutamate de type NMDA sur lequel le tPA agit sont impliqués de manière importante dans les processus de mémorisation, d'apprentissage mais aussi de mort neuronale ! »
Vers de nouveaux traitements plus sûrs
Bien que le tPA soit soupçonné de produire des effets délétères sur le cerveau, on ne savait pas précisément par quelle action. On pensait en effet que la protéase ne pouvait pas franchir la barrière hémato-encéphaliquebarrière hémato-encéphalique (BHE), qui sert d'interface sélective pour les molécules entre le sang et le tissu cérébral.
C'est pourtant précisément ce que l'équipe Inserm de Denis Vivien vient de démontrer. Ces travaux publiés dans Circulation montrent que, même chez des rats dont la barrière hématoencéphalique est intacte, le tPA peut passer dans le cerveau et potentialiser la mort neuronale. Mieux, le mécanisme exact a pu être identifié in vitroin vitro : le tPA atteint le cerveau par transcytose (en traversant les cellules) grâce à un récepteur spécifique, le LRP (LDL receptor-related protein).
D'intéressantes perspectives s'ouvrent donc dans le traitement des AVC ischémiques. « On peut désormais envisager d'améliorer l'efficacité du tPA en empêchant son passage dans le cerveau par blocage du récepteur LRP, ou de mettre au point de nouvelles formes de tPA qui n'interagiraient pas avec celui-ci, explique Denis Vivien. Quoi qu'il en soit, limiter l'accès du tPA aux neurones ou empêcher le tPA d'activer outre-mesure le récepteur aux glutamates NMDA améliorerait considérablement l'efficacité du traitement des AVC, et pourrait même permettre d'augmenter la duréedurée de la fenêtre thérapeutique. »
De tels outils devraient prochainement entrer dans les premières phases du processus des essais cliniquesessais cliniques. Avec à la clé un immense espoir de meilleur traitement pour les patients.