au sommaire
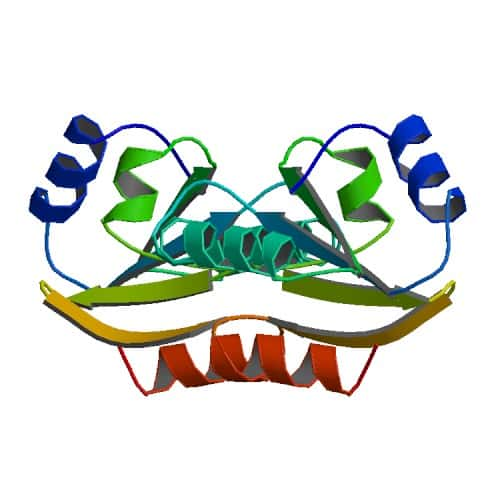
Les scientifiques ont étudié les ancêtres de la thiorédoxine actuelle. © ProteinBoxBot, Wikimedia, domaine public
- À lire : notre dossier sur les origines de la vie

Les origines de la vie sont encore débattues, entre les partisans d'une origine extraterrestre (par le biais d'une météoritemétéorite qui aurait apporté les premiers acides aminésacides aminés) et ceux qui penchent pour une apparition spontanée des acides aminés grâce aux conditions environnementales propices à des réactions chimiquesréactions chimiques particulières.
Quelle que soit l'origine des premiers acides aminés, les premiers organismes vivants qui les ont utilisés ont certainement émergé dans des conditions environnementales différentes de celles d'aujourd'hui, et probablement dans des milieux plus chauds et plus acides. C'est du moins les conclusions d'une étude originale, parue récemment dans la revue Nature Structural & Molecular Biology et menée par des scientifiques du Georgia Institute of Technology Research, du ColumbiaColumbia University et de l'Université de GrenadeGrenade en Espagne.
Un petit tour dans le passé
Pour le comprendre, ces biologistes ont réussi le défi de remonter le temps, grâce à des fonds octroyés par la NasaNasa, le NIH et le ministère espagnol des Sciences et de l'innovation. Ils ont en effet réussi à reconstituer d'anciennes enzymesenzymes appartenant à des espèces aujourd'hui disparues, mais qui ont certainement vécu sur la Terre primitive entre 1,4 et 4 milliards d'années avant notre ère.
Ils se sont intéressés particulièrement aux thiorédoxines, des enzymes retrouvées dans tous les organismes des trois domaines de la vie (bactériesbactéries, archéesarchées et eucaryoteseucaryotes). Ces enzymes sont nécessaires à plusieurs niveaux du métabolismemétabolisme cellulaire et agissent comme des antioxydantsantioxydants des protéinesprotéines grâce à leurs résidus cystéinescystéines.

Eric Gaucher en train d'observer les bactéries exprimant les enzymes ressucitées. © Georgia Tech/Gary Meek
Remonter le fil de l’Évolution
Une technique appelée « reconstruction ancestrale des séquences » a été utilisée. Pour cela, un arbre phylogénétique a été créé à partir des comparaisons des séquences de 200 thiorédoxines retrouvées chez des organismes contemporains, les séquences les plus semblables étant placées sur deux branches de l'arbre proches l'une de l'autre. En utilisant une méthode statistique et en faisant confiance à la probabilité la plus grande, les chercheurs ont obtenu des séquences de sept thiorédoxines ayant pu donner naissance, au fil du temps et de l'évolution (et donc de l'accumulation des mutations), aux thiorédoxines que l'on connaît à présent.
Grâce à la biologie moléculairebiologie moléculaire, les sept gènesgènes obtenus sur le papier ont été synthétisés sous forme de moléculesmolécules d'ADNADN, clonés dans des bactéries, et exprimés de façon à obtenir les protéines ancestrales. Les protéines purifiées ont ensuite pu être comparées à leurs homologues modernes, notamment en observant leur mécanisme d'action et leur résistancerésistance à différents facteurs physicochimiques.
Résistance à des pH acides et à des températures élevées
Même si les thiorédoxines ont conservé un mécanisme moléculaire d'oxydoréductionoxydoréduction semblable au fil des milliards d'années, elles ne possèdent pas les mêmes caractéristiques biochimiques. Ainsi, grâce à l'observation de chaque molécule unique (grâce à un microscope à force atomiquemicroscope à force atomique), les chercheurs ont pu montrer que les enzymes les plus anciennes sont capables d'assurer leur fonction à des pH plus faibles. À l'aide d'un calorimètre différentiel à balayage, qui mesure la résistance à la température, ils ont également constaté que les protéines les plus ancestrales pouvaient supporter jusqu'à 32°C de plus que les enzymes apparues plus récemment.
Ces résultats démontrent que les premiers organismes devaient être particulièrement bien adaptés à des milieux acides et chauds, comme l'étaient les océans de l'époque, et qu'ils ont ensuite évolué pour s'adapter progressivement aux modifications de leur environnement. « Nos résultats confirment que la vie a la remarquable capacité à s'adapter à une grande variété de conditions environnementales historiques ; et par extension, la vie va indubitablement s'adapter aux changements environnementaux futurs, bien qu'avec un coût pour beaucoup d'espèces », conclut Eric Gaucher, l'un des auteurs de l'article.