Des gouttes de vinaigre colorées qui font l’ascenseur dans une éprouvette remplie d’huile. Non, vous n’êtes pas sous l’emprise d’une quelconque drogue psychédélique. Simplement face à l’une de ces expériences qui font aimer la chimie. Les explications en vidéo de Maëlle Mosser, docteur en chimie à l’ENS de Lyon.
au sommaire
Le bicarbonate de soude, c'est une sorte de super produit. Il peut blanchir les dents. Il aide à rafraîchir l'haleine en désinfectant la bouche. Ou peut servir de déodorant en neutralisant les bactériesbactéries responsables de la mauvaise odeur de la sueur. Appliqué sur les cheveux, il absorbe aussi l'excès de sébum et peut donc servir de shampoing sec.
On trouve aussi du bicarbonate dans la levure chimique qui fait lever les pâtes. Et il est utilisé comme « générateur de CO2 » pour la fabrication des boissons gazeuses. Ainsi pour préparer une limonade maison, il suffit d'un peu d'eau, de jus de citron, de sucresucre... et de bicarbonate de soudesoude pour lui donner du pétillant.
C'est cette même capacité du bicarbonate de soude à générer du CO2 au contact d'un acide qui est exploitée dans l'expérience dite de l'ascenseurascenseur à gouttes.
Une expérience facile à mettre en œuvre
Pour reproduire l'expérience présentée dans la vidéo, il vous faudra réunir le matériel suivant :
- ÉprouvetteÉprouvette graduée de 250 mL
- 2 béchers de 50 mL
- 2 pipettes pasteur + propipette
- Huile de tournesoltournesol
- Vinaigre blanc
- Colorant alimentaireColorant alimentaire bleu et rouge
- Bicarbonate de soude (NaHCO3))
Le protocole à suivre ensuite est le suivant :
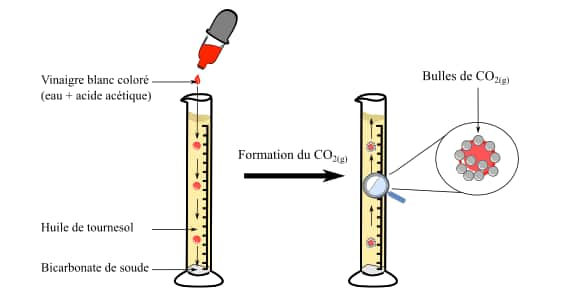
Mettre trois grosses spatules de bicarbonate de soude au fond de l'éprouvette graduée et remplir l'éprouvette avec de l'huile.
En parallèle, verser 10 mL de vinaigre blanc dans chacun des deux béchers et ajouter trois gouttes de colorant bleu dans l'un et trois gouttes de colorant rouge dans l'autre.
Prélever du mélange de vinaigre coloré avec une pipette pasteur et ajouter le goutte-à-goutte dans l'éprouvette graduée.
Observer la descente et la remontée des gouttes de vinaigre dans l'éprouvette graduée.
La descente des gouttes de vinaigre
Le vinaigre blanc est une solution aqueuse d'acide acétique (CH3COOH). Un vinaigre blanc standard possède une teneur en acide acétique de 8° ou 8 %, c'est-à-dire qu'il y a 80 g d'acide acétique dans 1 L (1 kgkg) d'eau. Cela représente une concentration molaire de 1,3 mol.L-1 d'acide acétique dans l'eau (MCH3COOH = 60 g.mol-1). Ainsi, le vinaigre blanc contient majoritairement de l'eau et sa densité est proche de celle de l'eau, soit 1 g.mL-1.
L'huile de tournesol, quant à elle, est une huile végétale composée de 98 % de triesters d'acides grasacides gras, elle possède une densité intermédiaire entre 0,918 et 0,923 g.mL-1, qui est inférieure à celle des gouttes de vinaigre coloré.
Le vinaigre blanc et l'huile ne se mélangent pas, on dit qu'ils sont non misciblesmiscibles. Le vinaigre étant plus dense que l'huile, les gouttes de vinaigre descendent au fond de l'éprouvette graduée.
La réaction chimique au fond de l'éprouvette
Une fois que les gouttes de vinaigre ont atteint le fond de l'éprouvette graduée, l'acide acétique contenu dans le vinaigre réagit avec le bicarbonate de soude selon une réaction acido-basiqueréaction acido-basique :
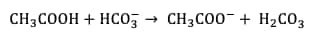
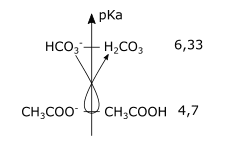
En effet, en mettant les deux couples acide-base sur une échelle de pKa, on constate que les espècesespèces vont bien réagir spontanément d'après la « règle du gamma » :
La constante d'équilibre de cette réaction est :
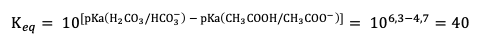
Or, l'acide carboniqueacide carbonique n'est pas stable dans l'eau et se décompose en dioxyde de carbonedioxyde de carbone (
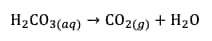
Des bulles de dioxyde de carbone se forment alors à la surface des gouttes de vinaigre coloré.
La remontée des gouttes de vinaigre
Les bulles de gazgaz formées restent à la surface des gouttes de vinaigre et, étant moins denses que l'huile et le vinaigre, elles remontent vers la surface en entraînant les gouttes de vinaigre avec elles. Une fois le dioxyde de carbone libéré dans l'airair, les gouttes de vinaigre retombent à nouveau au fond de l'éprouvette et le phénomène recommence jusqu'à consommation totale de l'acide acétique ou du bicarbonate de soude.
© Futura & ENS de Lyon
























