au sommaire
Résultats
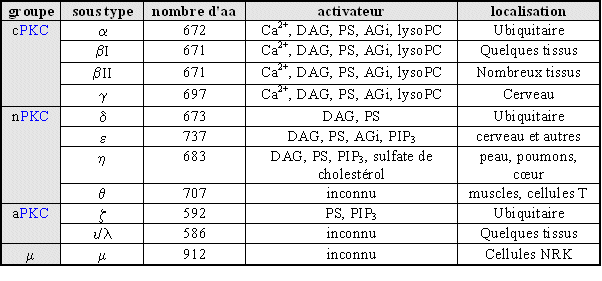
1.7.1. MISE AU POINT DU MODELE
1.7.1.1. Stimulation des granulocytes neutrophiles
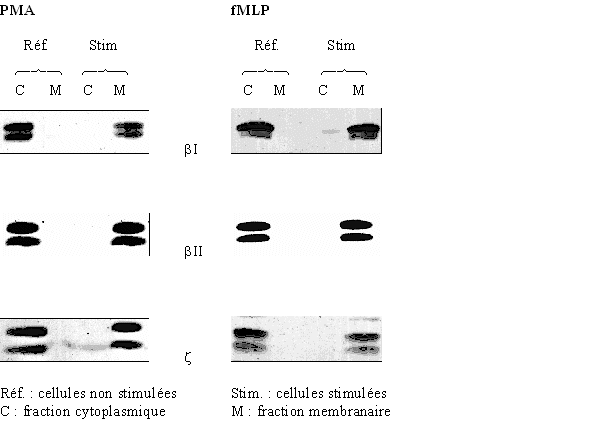
Comme nous l'avons déjà vu, les activateurs que nous avons choisis d'utiliser sont le PMAPMA et le fMLP. Il a fallu dans un premier temps définir les conditions dans lesquelles la protéineprotéine kinasekinase C est activée. Pour visualiser cette activité, nous avons cherché à quelle concentration et quel temps d'activation, avec chacun des activateurs, les différentes isoformes de la PKC étaient transloquées vers la membrane plasmiquemembrane plasmique (fig. 26). Cette visualisation a pu se faire en exploitant la technique de western blotwestern blot. Les isoformes présentes chez le granulocytegranulocyte neutrophileneutrophile sont : βI, βII et ζ.
La stimulationstimulation de la protéine kinase C est effective dans les conditions suivantes :
- PMA : 10 minutes à 160 nM à 37°C
- fMLP : 5 minutes à 1 µM à 37°C

fig. 26 : translocation de la protéine kinase C dans le granulocyte neutrophile stimulé par le PMA à 160 nM pendant 10 minutes ou le fMLP à 1 µM pendant 5 minutes
Nous avons pu montrer la translocationtranslocation de la protéine kinase C. En effet, dans le cas de cellules non stimulées, l'enzyme est présente dans la fraction cytoplasmique ; par contre, après stimulation, elle se situe dans la fraction membranaire. Ce résultat caractérise l'activation de chaque isoforme de la PKC et valide donc nos conditions d'utilisation pour la suite de la mise au point.
Il est possible de remarquer que pour chaque isoenzyme, deux bandes apparaissent par piste. Il s'agit, pour chaque cas, des formes phosphorylées (au-dessus) et non phosphorylées (en- dessous) de la PKC (Keranen L.M. et al., 1995) .
1.7.1.2. Purification de la protéine kinase C
Pour la suite des manipulations, à savoir l'étude de liaison et la mesure de l'activité enzymatiqueenzymatique, il est nécessaire de travailler sur une enzyme purifiée. Ceci a été effectué par chromatographie échangeuse d'ions sur une colonne DEAE-Sephacel.
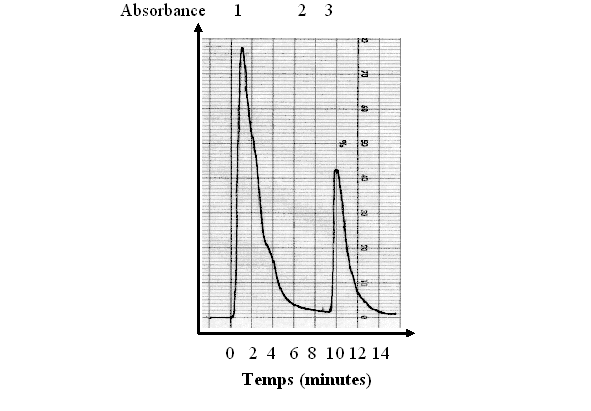
1 : lavage de la colonne par 10 ml de tampon 2 : ajout de NaCl 150 mM 3 : élution de la PKC
fig. 27 : Chromatogramme obtenu avec une lecture à 280 nm
Cette méthode permet d'obtenir rapidement une enzyme suffisamment purifiée pour la suite de l'expérimentation avec une mise en œuvre relativement simple.
L'élution est suivie par un détecteur UVUV-visible, la lecture se fait à 280 nm (fig. 27), cette longueur permettant de détecter la présence de protéine et donc de déterminer à quel moment de l'élution la protéine kinase C est susceptible d'être présente.
Pour être sûr que les différentes isoenzymes soient présentes, un western blot est pratiqué avec l'extrait cellulaire pur (1), le pic correspondant au premier lavage de la colonne (2), celui supposé contenir la protéine kinase C (3) et un dernier avec un lavage fait avec le tampon additionné de chlorure de sodium à la concentration de 2 M (4) (fig. 28). Grâce aux résultats des différents western blot, la caractérisation du pic où était supposée se trouver la PKC a permis de confirmer la présence des trois isoformes de l'enzyme à ce stade de l'élution.
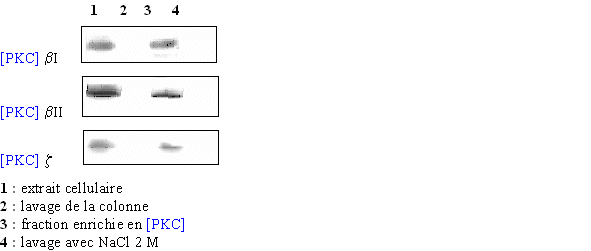
fig. 28 : Western blot correspondant à chaque fraction obtenue en suivant le spectre de la chromatographie
1.7.1.3. Evaluation de la cytotoxicité
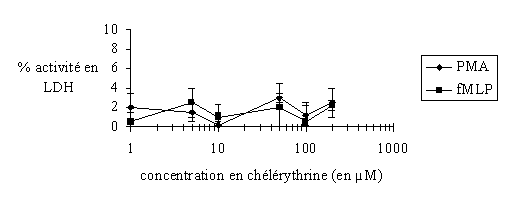
fig. 29 : Evaluation de la cytotoxicité de la chélérythrine sur les granulocytes neutrophiles avec une stimulation par le PMA 160 nM ou le fMLP 1 µM (n=6).
Avant de tester une molécule, il faut tout d'abord s'assurer qu'elle n'altère pas les granulocytes neutrophiles. Pour cela, un dosagedosage de lactatelactate déshydrogénase est pratiqué dans le surnageant des cellules et dans les conditions qui seront utilisées par la suite afin de déterminer la cytotoxicité du composé.
Les concentrations prises pour la chélérythrine vont de 1 µM à 200 µM, deux cas sont considérés : une activation par le PMA à 160 nM pendant 10 minutes à 37°C et une autre par le fMLP à 1 µM pendant 5 minutes à 37 °C. Dans chacun d'entre eux la cytotoxicité est totalement absente puisque l'activité LDH est toujours inférieure à 5% (fig. 29).
1.7.1.4. Evaluation de l'activité antioxydante
Avant de réaliser ce dosage il a fallu s'assurer que la chélérythrine ne possède pas d'action directe sur l'anionanion superoxyde produit. Ceci est vérifié dans un modèle acellulaire utilisant le système xanthine-xanthine oxydaseoxydase pour produire l'anion dosé ultérieurement, pour des concentrations utilisées en chélérythrine comprises entre 1 et 200 µM, la diminution de la quantité en anion superoxyde est inférieure à 5%.
L'influence de la chélérythrine sur la production d'anion superoxyde a été évaluée après une préincubation de 15 minutes à 37°C, puis les granulocytes neutrophiles ont été stimulés soit par le PMA à 160 nM pendant 10 minutes à 37°C, soit par le fMLP à 1 µM pendant 5 minutes à 37°C.
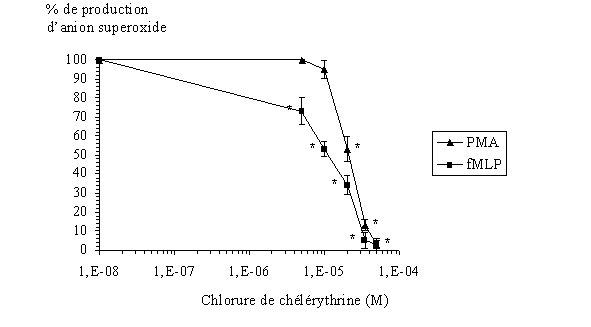
fig. 30 : Effet de la chélérythrine sur la production d'anions superoxyde par les granulocytes neutrophiles avec une stimulation par le PMA ou le fMLP (n=6, * significativement différent de la référence pour p
Dans chaque cas, l'inhibitioninhibition de la production d'anion superoxyde est de 100 % pour les concentrations les plus élevées en inhibiteur, c'est à dire 50 µM. Ce qui montre l'activité antioxydante de la chélérythrine sur les granulocytes neutrophiles lors de la flambée respiratoire. Les concentrations inhibitrices à 50 % sont de 11,6 µM ± 1,6 pour une activation de 10 minutes par le fMLP et de 21,1 µM ± 2,1 dans le cas d'une stimulation de 5 minutes par le PMA (fig . 30).
1.7.1.5. Etude de liaison
Cette étude permettra de confirmer l'action de la chélérythrine sur la protéine kinase C. Le ligandligand marqué qui est utilisé est le phorbol-12,13-dibutyrate tritié, son site de fixation est le même que celui du PMA, c'est à dire sur celui du domaine régulateur de l'enzyme. Nous avons travaillé sur la protéine kinase C partiellement purifiée par chromatographie DEAE-Sephacel, la mesure se fait sur l'ensemble des isoformes contenues dans les granulocytes neutrophiles.
Afin de mettre au point ce modèle, il a tout d'abord fallu définir les conditions les plus favorables. Ainsi, l'incubation avec le ligand marqué se fait à 30°C pendant 10 minutes. La liaison non spécifique, déterminée en utilisant le phorbol-12,13-dibutyrate froid, est inférieure à 10%. Pour valider le protocoleprotocole, nous avons effectué une mesure de la constante de dissociation (Kd) que nous avons comparée avec les valeurs habituellement publiées pour la protéine kinase C. Cette constante a été déterminée d'après la méthode de Lineweaver et Burk, le Kd obtenu est de 3,7 µM (fig. 31).
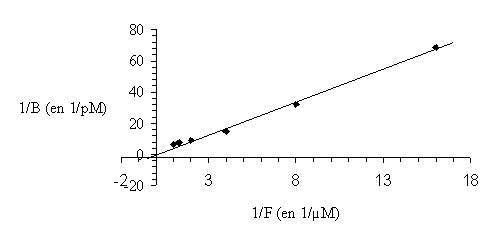
fig. 31 : Détermination de la constante de dissociation du PDB tritié pour la PKC par la méthode de Lineweaver et Burk.
Afin de montrer une action inhibitrice de la chélérythrine sur le couplage du PDB tritié avec l'ensemble des isoformes de la PKC, nous avons préincubé les protéines contenues dans le milieu avec cet inhibiteur. Pour les concentrations les plus élevées, nous avons pu remarquer une absence totale de liaison de l'esterliaison de l'ester de phorbol avec l'enzyme. La concentration inhibitrice à 50% obtenue est de 0,710 µM 0,016 (fig. 32).
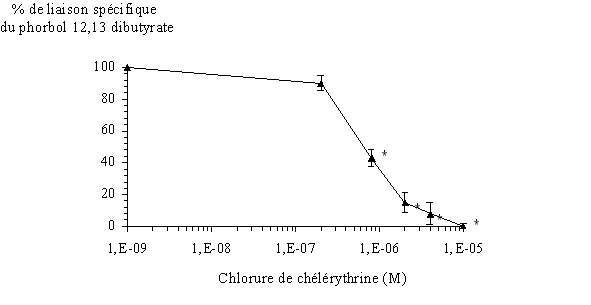
fig. 32 : Inhibition de la fixation du 3H PDB avec la protéine kinase C par la chélérythrine (n=6, * significativement différent de la référence pour p
1.7.1.6. Inhibition de la translocation
L'inhibition de la translocation de la protéine kinase C du cytoplasmecytoplasme vers la membrane plasmique est mise en évidence par la même technique de western blot que précédemment et dans les mêmes conditions d'activation. La stimulation des granulocytes neutrophiles est faite par le PMA ou le fMLP, pour montrer l'influence de la chélérythrine, deux concentrations sont utilisées : 4 µM pour une faible activité inhibitrice et 40 µM où l'inhibition est supposée être totale.
Les cellules sont tout d'abord préincubées avec le chlorure de chélérythrine pendant 15 minutes à 37°C à la concentration de 4 µM ou de 40 µM, puis elles sont activées par le PMA à 160nM pendant 5 minutes ou le fMLP à 1µM pendant 10 minutes (fig. 33).
Pour les isoformes βI, βII et ζ de la protéine kinase C, nous pouvons constater que pour les références stimulées et non stimulées aussi bien par le PMA que par le fMLP, la translocation de l'enzyme est obtenue. Il en est de même pour une concentration faible en inhibiteur puisque la PKC est présente uniquement dans la fraction membranaire ; par contre en ce qui concerne la concentration de 40 µM en chélérythrine, la protéine kinase C est présente dans tous les cas essentiellement dans la fraction cytoplasmique, ce qui indique une absence quasi totale de la translocation et donc une inactivation de cette enzyme.
Ici aussi, il est possible de voir les formes phosphorylées et non phosphorylées de la protéine par une migration électrophorétique différente d'où la présence de deux bandes par piste. Il est à remarquer que l'inhibition par le chlorure de chélérythrine touche indifféremment ces deux formes.
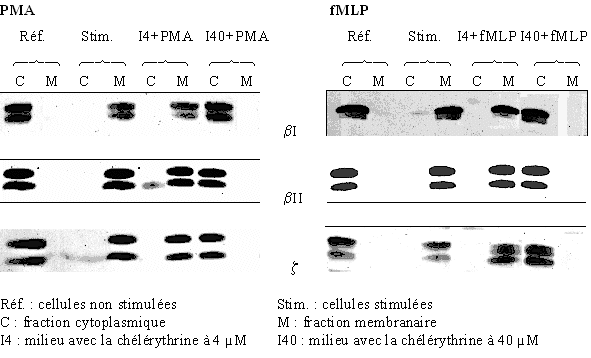
fig. 33 : Inhibition par la chélérythrine de la translocation de la PKC avec une stimulation des cellules par le PMA 160 nM pendant 5 minutes ou par le fMLP 1 µM pendant 10 minutes
1.7.2. ETUDE DES MOLECULES DE REFERENCE
1.7.2.1. Evaluation de l'activité antioxydante
Les molécules prises comme référence sont le HA-1077 et le Y-32885. Il a fallu tout d'abord s'assurer que ces composés ne changent pas les propriétés biologiques des polymorphonucléaires neutrophiles, ceci a été vérifié en estimant la cytotoxicité. Le pourcentage d'activité de la LDH dans le milieu ne passe pas 5% pour des concentrations allant de 5.10-3 M à 1.10-7 M pour les deux produits testés, ce qui montre qu'ils ne sont pas cytotoxiquescytotoxiques pour les cellules.
Il a été contrôlé que ces composés n'interagissaient pas avec l'anion superoxydes produits (
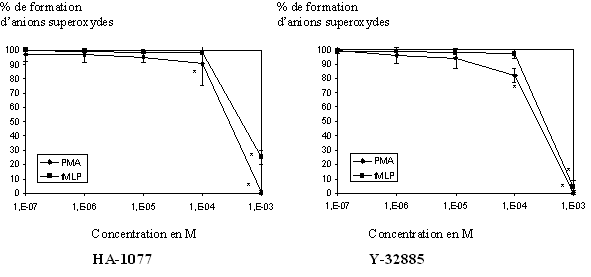
fig. 34 : Action du HA-1077 et du Y-32885 sur la production d'anion superoxyde chez le granulocyte neutrophile (n=6, * significativement différent de la référence pour p
Les granulocytes neutrophiles stimulés par le PMA 160nM pendant 5 minutes ou par le fMLP 1µM pendant 10 minutes sont capables de produire une importante quantité d'anions superoxydes. Après incubation avec les molécules de références, cette production diminue de façon concentration dépendante pour totalement être inhibée pour les plus fortes concentrations. Les CI50 calculées pour le HA-1077 sont de 1,88.10-4 M ± 0,21.10-4 pour une activation par le PMA et de 5,26.10-4 M ± 0,16.10-4 pour une activation par le fMLP. Le calcul des CI50 pour le Y-32885 a donné 1,48.10-4 M ± 0,14.10-4 pour une activation par le PMA et 2,68.10-4 M ± 0,08.10-4 pour une stimulation par le fMLP (fig. 34).
1.7.2.2. Etude de liaison
Pour démontrer que le HA-1077 et le Y-32885 sont impliqués dans l'inhibition du stress oxydatifstress oxydatif chez le granulocyte neutrophile, nous avons étudié l'influence que ces composés avaient sur la liaison de l'enzyme avec une molécule considérée comme ligand spécifique de la PKC. Après une incubation de 15 minutes des inhibiteurs potentiels avec l'extrait cellulaire, le phorbol-12, 13-dibutyrate tritié est additionné au milieu et nous mesurons une variation de liaison en comparaison avec un milieu sans inhibiteur. Les CI50 de l'étude de liaison sont de 1,317.10-6 M ± 0,057.10-6 quand le HA-1077 est utilisé et de 0,789.10-6 M ± 0,024.10-6 avec le Y-32885 et ces diminutions de liaison sont réalisées de manière concentration dépendante (fig. 35).
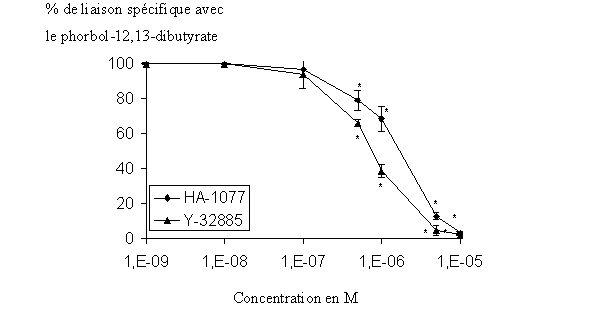
fig. 35 : Action du HA-1077 et du Y-32885 sur la liaison du phorbol-12, 13-dibutyrate avec la protéine kinase C (n=6, * significativement différent de la référence pour p
1.7.2.3. Inhibition de la translocation par le HA-1077 et le Y-32885
La visualisation de la présence ou non de la translocation a été suivie par western blot. La stimulation des cellules a été faite par le PMA 160 nM pendant 5 minutes ou par le fMLP 1 µM pendant 10 minutes. Deux concentrations de HA-1077 et de Y-32885 ont été utilisées : 0,01 mM et 1 mM pour montrer une influence de ces composés sur la translocation de la protéine kinase C.
Pour les trois isoformes (βI, βII et ζ)) de l'enzyme, nous avons vérifié la translocation de la protéine vers la membrane plasmique au cours de son activation et ce, quel que soit le stimulant utilisé. Pour une faible concentration en inhibiteur (0,01 mM), nous avons montré que le changement de localisation du cytoplasme vers la membrane plasmique est conservé. Au contraire, quand la concentration est plus élevée (1 mM), nous avons été incapables de voir la translocation de la PKC en utilisant les mêmes conditions de stimulation (fig. 36).
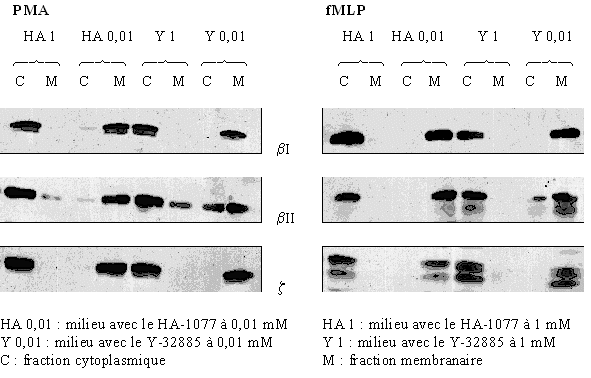
fig. 36: Inhibition par le HA-1077 et le Y-32885 de la translocation de la PKC avec une stimulation des granulocytes neutrophiles par le PMA à 160 nM pendant 5 minutes ou par le fMLP à 1 µM pendant 10 minutes.
1.7.3. ETUDE DES MOLECULES ORIGINALES
1.7.3.1. Evaluation de l'activité antioxydante
Comme pour les molécules précédentes, il est nécessaire de vérifier que ces composés originaux ne sont pas cytotoxiques. Après avoir mesuré l'activité de la lactate déshydrogénase, nous avons pu nous rendre compte que le CED-28, le CED-32, le CED-33 et le CED-39 n'altèrent en rien la membrane des granulocytes neutrophiles (-3 M à 1.10-7 M.
Le modèle acellulaire nous a permis de vérifier l'absence d'interaction directe entre les différentes molécules et l'anion superoxyde pour des concentrations ayant une amplitude de 5.10-3 M à 1.10-7 M.
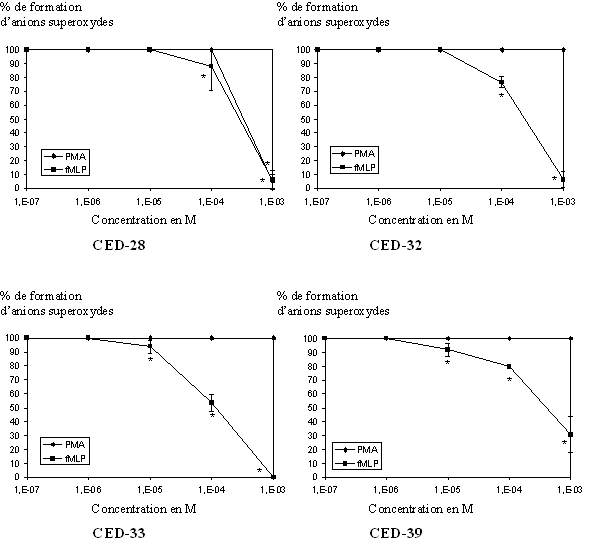
fig. 37 : Action du CED-28, du CED-32, du CED-33 et du CED-39 sur la production d'anions superoxydes (n=6, * significativement différent de la référence pour p
Après avoir pris en compte ces deux premiers paramètres, nous avons pu évaluer l'activité antioxydante des quatre composés. Pour le CED-28, les CI50 calculées sont de 5,73.10-4 M ± 0,25.10-4 pour une activation par le PMA et de 5,15.10-4 M ± 0,22.10-4 lorsque le fMLP est utilisé, l'inhibition se fait de manière concentration dépendante et elle est totale pour les concentrations les plus élevées. Pour le CED-32, nous n'obtenons aucune inhibition lorsque les cellules sont activées par le PMA, par contre nous avons une diminution de la production d'anion superoxyde de façon concentration dépendante et une absence totale de cet anion pour une concentration de 10-3 M. Avec le fMLP comme stimulant, la CI50 calculée est de 4,94.10-4 M ± 0,09.10-4. Le CED-33 est également inactif sur la production d'anion superoxyde et comme précédemment, nous observons une inhibition dans le cas où le fMLP est activateur, la CI50 est alors de 3,59.10-4 M ± 0,12.10-4. De même, le CED-39 n'a aucune influence sur la formation de l'anion recherché quand il est produit en utilisant le PMA comme activateur, par contre, avec le fMLP comme stimulant, sa production diminue de façon concentration dépendante mais n'est pas totalement inhibée pour une concentration de 10-3 M, la CI50 mesurée est de 6,82.10-4 M ± 0,08.10-4 (fig. 37).
1.7.3.2. Etude de liaison
Cette étude de liaison nous permettra d'avoir un premier élément de réponse pour expliquer les résultats obtenus avec le modèle cellulaire.
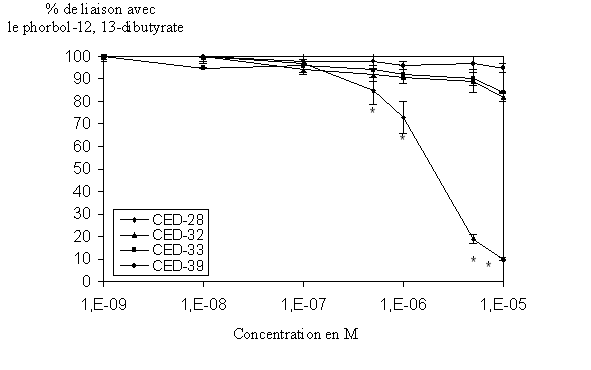
fig. 38 : Action du CED-28, du CED-32, du CED-33 et du CED-39 sur la liaison du phorbol-12, 13-dibutyrate avec la protéine kinase C (n=6, * significativement différent de la référence pour p
Les molécules CED-32, CED-33 et CED-39 ne donnent aucune variation significative de la liaison de l'ester de phorbol pour l'enzyme, en effet, avec une concentration de 1.10-5 M cette liaison s'effectue avec plus de 80% pour les trois composés. Au contraire, le CED-28 est capable d'inhiber le couplage enzyme-ligand quasi totalement (>90%) et ce de façon concentration dépendante, la CI50 calculée est de 4,097.10-6 M ±,089.10-6 (fig. 38).
1.7.3.3. Inhibition de la translocation par les molécules originales
Afin de confirmer l'action inhibitrice du CED-28 sur la protéine kinase C et une absence d'activité des trois autres molécules sur l'enzyme, nous avons cherché à voir quelle influence pouvait avoir ces composés sur la tanslocation de la PKC du cytoplasme vers la membrane plasmique.
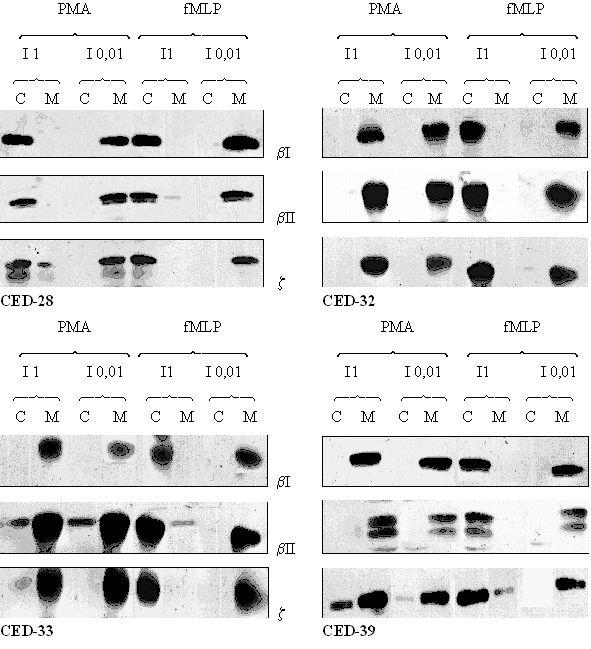
fig. 39 : Acticité du CED-28, du CED-32, du CED-33 et du CED-39 sur la translocation de la protéine kinase C après une stimulation des granulocytes neutrophiles par le PMA 160 nM pendant 5 minutes ou le fMLP 1 µM pendant 10 minutes.
Comme dans les expériences précédentes, des témoins ont été réalisés afin de vérifier les capacités des cellules utilisées pour transloquer la protéine kinase C. Les stimulations sont les mêmes à savoir le PMA à 160 nM pendant 5 minutes et le fMLP à 1 µM pendant 10 minutes. Pour chaque inhibiteur potentiel, deux concentrations sont utilisées : une faible de 0,01 mM et une élevée de 1mM.
Pour le CED-28, nous pouvons observer que pour une faible concentration en composé, la translocation est conservée. Par contre lorsque nous utilisons une concentration plus élevée, nous notons une absence totale de déplacement de l'enzyme à l'intérieur des granulocytes neutrophiles, ceci est valable pour les trois isoformes (βI,βII et ζ) de la protéine kinase C.
Pour les trois autres molécules : CED-32, CED-33 et CED-39, quelle que soit la concentration en produit qui est mise dans le milieu, nous n'avons pas réussi à voir une inhibition de la translocation des trois isoformes de la PKC du cytoplasme des cellules vers leur membrane plasmique lorsque le PMA est utilisé comme activateur. Lorsque nous utilisons le fMLP comme stimulant, la translocation des trois isoformes est inhibée pour une concentration élevée en inhibiteur, et elle est conservée pour une concentration plus faible (fig. 39).