On en sait un peu plus sur les infections graves de la Covid-19. Une étude montre comment une partie de la protéine S du SARS-CoV-2 peut endommager les barrières cellulaires qui tapissent l'intérieur des vaisseaux sanguins dans les organes comme les poumons.
au sommaire
Une contamination par le SARS-CoV-2 se présente sous des formes variables, qui vont de l'infection asymptomatique non grave (avec des symptômes de type grippal) vers des cas plus graves associés à des lésions pulmonaires aiguës et au syndrome de détresse respiratoire aiguë (SDRA). La pathologie pulmonaire de la Covid-19 sévère implique un œdèmeœdème pulmonaire qui résulte d'un dysfonctionnement des barrières épithéliale et endothéliale. Bien qu'il soit reconnu qu'une réponse inflammatoire exagérée est associée à cette dysfonction, les déclencheurs spécifiques de l'hyperperméabilité épithéliale et endothéliale ainsi que l'implication de facteurs viraux particuliers ne sont pas clairs.
Une étude publiée dans la revue Nature Communications montre comment une partie de la spike protein (ou protéineprotéine S) du SARS-CoV-2SARS-CoV-2 -- une toxinetoxine virale -- peut endommager les barrières cellulaires qui tapissent l'intérieur des vaisseaux sanguins dans les organes du corps, comme les poumonspoumons. « Ce qui est vraiment intéressant, c'est que la protéine spike circulante est en corrélation avec les cas graves de Covid-19 dans la clinique », a déclaré Scott Biering, chercheur postdoctoral à l'université de Californie à Berkeley et coauteur de l'étude. « Nous avons voulu savoir si cette protéine contribuait également à la fuite vasculaire que nous avons observée dans le contexte du SARS-CoV-2. »
La fuite vasculaire à l’origine des cas graves de Covid-19
Une fuite vasculaire se produit lorsque les cellules qui tapissent les vaisseaux sanguins et les capillaires sont perturbées, ce qui permet au plasmaplasma et à d'autres fluides de s'échapper de la circulation sanguine. Dans les cas graves de Covid-19, cela engendre des lésions pulmonaires et cardiaques, que les scientifiques attribuent à la « tempêtetempête de cytokinescytokines », une réponse immunitaireréponse immunitaire hyperactive.
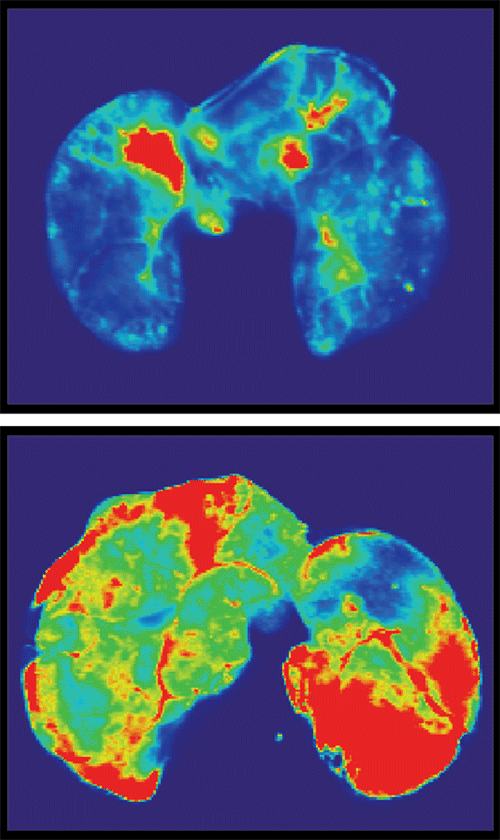
Pour tester désormais l'implication de la protéine S, les chercheurs de la nouvelle étude ont utilisé de fines couches de cellules endothéliales et épithéliales humaines, lesquelles imitent les revêtements des vaisseaux sanguins dans le corps. Ils ont constaté que l'exposition de ces couches cellulaires à la protéine S augmentait leur perméabilité, une caractéristique de la fuite vasculaire.
Dans le détail, comment la protéine S déclenche-t-elle cette perméabilité ? À l'aide du séquençageséquençage de l'ARNARN, les chercheurs ont identifié une voie de signalisation moléculaire qui fait intervenir des glycanes, des intégrines et le facteur de croissancefacteur de croissance transformant bêtabêta (TGF-β). En bloquant l'activité des intégrines, l'équipe a pu inverser la fuite vasculaire chez la souris.
La protéine S serait la seule responsable
En outre, la protéine S serait suffisante pour provoquer la fuite vasculaire, qui se produirait donc indépendamment de l'infection virale elle-même. En effet, les chercheurs ont constaté que les souris exposées à la protéine S présentaient également une fuite vasculaire, même si les souris n'expriment pas le récepteur ACE2 humain et ne peuvent pas être infectées par le SARS-CoV-2. Pour rappel, la protéine S se lie au récepteur ACE2 sur les cellules humaines et celles d'autres mammifèresmammifères, ce qui permet au virusvirus de pénétrer dans la cellule et de détourner la fonction cellulaire.
« L'étude de ce processus pourrait nous aider à développer un nouvel arsenal de médicaments, de sorte que si quelqu'un souffre d'une fuite vasculaire, nous pourrions simplement cibler ce point », a déclaré Biering. L'équipe continue d'étudier les mécanismes moléculaires qui conduisent à la fuite vasculaire, mais également les toxines virales possibles dans d'autres virus qui provoquent des maladies graves chez l'humain.