au sommaire
Les carbures métalliques sont des molécules qui font intervenir le carbone et un métal, le plus souvent, ou un non-métal comme le silicium. Le méthane pourrait être considéré comme du carbure d'hydrogènehydrogène.

Cémentite ou carbure de Fe : Fe3C
C'est un composé cristallin de ferfer et de carbure de fer, la cémentitecémentite est magnétique jusqu'à 210 °C. C'est une combinaison très dure mais très fragile. Elle a une très bonne tenue à l'abrasionabrasion et à l'érosion. Elle est très présente dans d'autres constituants : perliteperlite, tröstite, sorbite.
Carbure de silicium : formule chimique SiC
Le carbure de siliciumcarbure de silicium est aussi connu sous le nom de carborundum ou de moissanite. Formule chimique SiC, composé noir dont la température de fusionfusion avoisine les 3.000 K, et la densité est de 3,217. Sa duretédureté est de 30 GPa, son module d'Young de 450 GPa et sa résistancerésistance à la flexionflexion de 400 MPa.
MinéralMinéral presque exclusivement artificiel, il est utilisé :
- en bijouterie, sous le nom de moissanite, comme imitation du diamantdiamant ;
- comme abrasif : carborundum (marque déposée de DuPont) ;
- en électronique, comme semi-conducteursemi-conducteur à large bandeà large bande ;
- avec l'aluminiumaluminium, pour former l'Al-SiC, un isolant aux propriétés thermiques intéressantes ;
- en mécanique ;
- dans la constructionconstruction de certains fours.
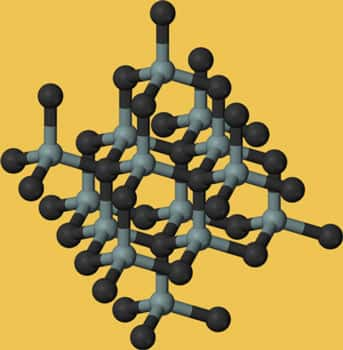
La « moissanite » a été synthétisée par le chimiste français Henri Moissan (1852-1907. Le carbure de silicium est formé par action à chaud du silicium sur le carbone ou par réduction de la silicesilice par un excès de carbone. Les carbures sont des corps thermiquement stables, durs et chimiquement inertes.

La carborandite est une céramiquecéramique composée de silicium et de carbone. C'est un minéral artificiel résultant du chauffage à plus de 1.200 °C d'un mélange de carbone et de silice en présence d'un fondant contenant des éléments métalliques. La couleurcouleur du minéral peut varier selon son état d'oxydationoxydation. DéchetDéchet de fabrication du carborundum, il est apprécié des collectionneurs de minérauxminéraux. C'est une pierre très légère et résistante aux chocs.
Carbure de tungstène (WC)
Il est très utilisé dans les outils de coupe (55 %)), les trépanstrépans (20). Le principe de fabrication des carbures cémentés est le suivant : la poudre de W est portée à 1.500 °C en présence de noir de fumée. WC ainsi obtenu est broyé en présence, éventuellement, de poudre de Co et /ou de TiC et TaC. La poudre est pressée puis frittée sous vide à 1.400 °C. On obtient ainsi un composite, formé d'une phase très dure (WC) dans une phase liante (Co). Exemple de composition : WC : 88 %, Co : 12 %.

Carbure de calcium et lampe de mine
Préparation : cokecoke et chaux vivechaux vive sont broyés puis tamisés séparément. Le mélange coke-chaux vive est introduit dans un four électrique et à 1.800 °C, le mélange se transforme en carbure de calciumcalcium par passage d'un courant électriquecourant électrique de fort ampérage.
Le carbure de calcium réagit avec l'eau pour donner de l'acétylène et de la chaux éteinte. L'acétylène est un gazgaz très inflammable, très instable, très explosif, sans odeur donnant une flamme très blanche et très chaude. Le carbure de calcium utilisé n'est pas pur et la réaction va former d'autres gaz tel que la phosphine (PH3) et le sulfure d'hydrogènesulfure d'hydrogène (H2S).
Utilisation du carbure de calcium en spéléologie
En spéléologiespéléologie, l'acétylène est fabriqué dans la calebonde par réaction avec l'eau au fur et à mesure de sa consommation, ce qui exclut tout danger d'explosion si la calebonde est correctement utilisée.
L'acétylène ainsi formé est enflammé au niveau du casque par une étincelle. Si la combustioncombustion n'est pas totale il y a formation de carbone solidesolide et de monoxyde de carbonemonoxyde de carbone. Le réglage de la calebonde est donc important pour avoir un débitdébit suffisant d'acétylène sous peine d'asphyxieasphyxie !
Une calebonde spéléo contient environ 400 grammes de carbure de calcium impur. En admettant 20 % d'impuretés, il reste 320 grammes de carbure pouvant former de l'acétylène. La réaction du carbure de calcium va consommer 187,6 grammes d'eau et former 5,2 mol d'acétylène.
Si le réglage d'eau est correctement effectué, la pressionpression d'acétylène est légèrement supérieure à la pression atmosphériquepression atmosphérique. La calebonde en fonctionnement atteint une température d'environ 50-60 °C. À une pression d'environ 1.2 barsbars, on peut avoir huit heures d'éclairage.