au sommaire
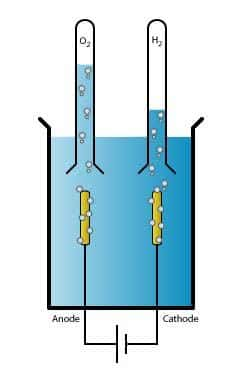
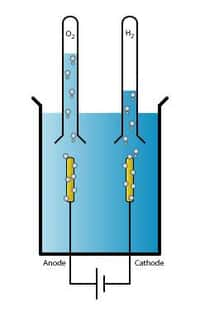
L'électrolyse de l'eau, ou hydrolyse, est une technique qui produit du dihydrogène (H2) et du dioxygène (O2) en partant de l’eau, grâce à un courant électrique. © Adam Rędzikowski, Wikimedia Commons, cc by sa 3.0
Souvent évoqué comme le carburant du futur, l'hydrogène est un bon candidat pour alimenter les voituresvoitures dotées de piles à combustible. Mais il rencontre un plusieurs écueils : sa production avec les méthodes actuelles (comme l'électrolyse) reste chère, peu efficace, et impacte l'environnement.
Aussi, la possibilité de produire de l’hydrogène à partir d'eau et de lumière du soleil est suivie avec sérieux, et plusieurs recherches récentes en témoignent. En 2008, des chercheurs russes avaient proposé une méthode de photosynthèsephotosynthèse artificielle dans ce but. Une équipe suisse poursuit le même objectif, en tournant ses recherches vers l'eau et l'oxyde de fer, plus communément appelé rouillerouille. L'an dernier, cette équipe courait toujours après un rendement de conversion de 10 % de l'énergieénergie solaire en hydrogène.
Conversion bon marché de l’énergie solaire en hydrogène
Dans le même ordre d'esprit, des chercheurs de l'université de technologie de Delft (Pays-Bas) et du Helmholtz-Zentrum Berlin (HZB) ont couplé une cellule solaire simple et une photoanode en oxyde métallique, ont réussi à atteindre un taux de conversion de 5 % de l'énergie lumineuse en hydrogène. Selon les scientifiques, leur dispositif est nettement moins coûteux que des cellules de haut rendement à triple jonction en siliciumsilicium amorpheamorphe ou d'autres semi-conducteurssemi-conducteurs utilisés pour ce type de réaction. Leurs résultats sont exposés dans la revue Nature Communications.

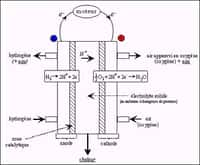
Quand la lumière (flèche arc-en-ciel) atteint le système, un potentiel électrique est créé. La couche d’oxyde métallique (grad-doped BiVO4) capte une partie de la lumière et sert de photoanode. La couche est reliée à la cellule solaire (en noir) par l’intermédiaire d’un pont conducteur en graphite. La cellule reçoit également une partie de la lumière, augmentant le potentiel électrique. L’oxygène se forme alors au niveau de la photoanode, tandis que l’hydrogène est dégagé au niveau d’une spirale de platine plongée dans l’eau et qui fait office de cathode. © Université de technologie de Delft
Pour leur photoanode, le choix s'est porté sur le vanadate de bismuthbismuth (BiVO4)), qui, à l'instar de la cellule solaire simple, a un coût modique : il est disponible en abondance, et est utilisé comme pigmentpigment jaune dans les peintures. Son usage permet en principe d'atteindre un taux de conversion de 9 % de l'énergie lumineuse en hydrogène dans le dispositif des chercheurs. Cet oxyde métallique a donc été déposé sur une surface de verre conducteur. Puis l'on a recouvert le tout d'un catalyseur bon marché, le phosphatephosphate de cobaltcobalt, en contact avec l'eau, et qui aide à accélérer notablement la formation de dioxygène. Le tout repose sur la cellule solaire, et celle-ci n'est donc pas en contact avec l'eau.
Le plus grand défi, pour les chercheurs, résidait dans la séparationséparation correcte des charges au sein de l'oxyde métallique. En d'autres termes, il s'agissait d'éviter leur recombinaisonrecombinaison : si les charges se recombinent, elles ne sont plus disponibles pour la réaction d’électrolyse, le but premier du dispositif. L'ajout d'atomesatomes de tungstène au sein de la couche d'oxyde métallique remplit ce rôle. « L'important était de distribuer ces atomes de manière à générer un champ électriquechamp électrique dans la couche, qui aide à empêcher les recombinaisons », explique Roel van de Krol, qui a dirigé ces travaux. En revanche, les chercheurs ne comprennent pas encore totalement pour quelle raison le vanadate de bismuth présente de meilleurs résultats que les autres oxydes métalliques. CeriseCerise sur le gâteau, « plus de 80 % des photonsphotons incidents contribuent au courant, une valeur inattendue qui établit un nouveau record pour un oxyde métallique », poursuit Roel van de Krol.
Vers une production significative d’hydrogène directement sur les toits ?
Les scientifiques ont ainsi obtenu un moyen relativement simple et peu onéreux de convertir de l'énergie solaire en hydrogène grâce à un procédé de photosynthèse artificielle. Une fois l'hydrogène stocké, on peut s'en servir sous différentes formes : dans des piles à combustible ou encore sous forme de méthane, selon l'usage visé.
Reste la question de la montée en échelle, et les chercheurs vont y consacrer leurs prochains efforts. Avec le rendement actuel de 5 % dans la conversion de la lumière solaire en hydrogène, et en prenant une performance solaire de l'ordre de 600 W/m2 en Allemagne, un peu plus d'une trentaine de mètres carrés suffiraient pour dépasser la barre du kilowattheure stocké chaque heure sous forme d'hydrogène.