au sommaire
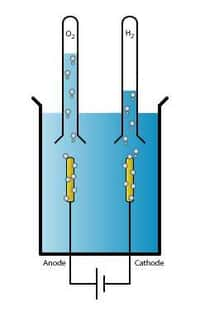
L'électrolyse de l'eau est une technique qui sépare le dihydrogène (H2) du dioxygène (O2), les deux composés de l'eau, à partir d'un courant éléctrique. © Wikipédia, Licence art libre
L'utilisation de l'énergie solaire est une alternative à l'énergie fossileénergie fossile. Mais difficile à stocker, elle n'est utilisable qu'en instantané et lorsque le temps le permet. Il existe toutefois un moyen de stockage, sujet à de nombreuses recherches. Il s'agit d'utiliser le solaire pour électrolyser l'eau et former de l'hydrogène. Un procédé parfait sur le papier : on utilise l'énergie solaire pour créer un carburant sans empreinte carbone et hautement énergique. Mais les procédés de transformation du solaire à l'hydrogène sont excessivement onéreux et le rendement est faible.
Alors, l'électrolyse de l'eau par l'énergie solaire restera-t-elle un processus onirique ? Rien n'est moins sûr. Une équipe de l'École polytechnique fédérale de Lausanne (EPFL)) développe une technique d'utilisation de l'énergie solaire pour produire de l'hydrogène à base de rouille et d'eau ! Produit peu cher et facilement utilisable, l'oxyde de fer pourrait ainsi trouver un usage inattendu. Le dispositif, encore à l'état expérimental, est décrit dans un article paru cette semaine dans le magazine Nature Photonics.
L'idée de transformer l'énergie solaire en hydrogène n'est pas nouvelle. Cela fait plus de 40 ans que les scientifiques y travaillent. L'EPFL a rejoint l'équipe de Michaël Gratzel qui inventa la cellule tandem photoélectrochimique (Pec) dans les années 1990. Dans ce petit dispositif, autonome, les électrons produits sont utilisés pour casser les moléculesmolécules d'eau.
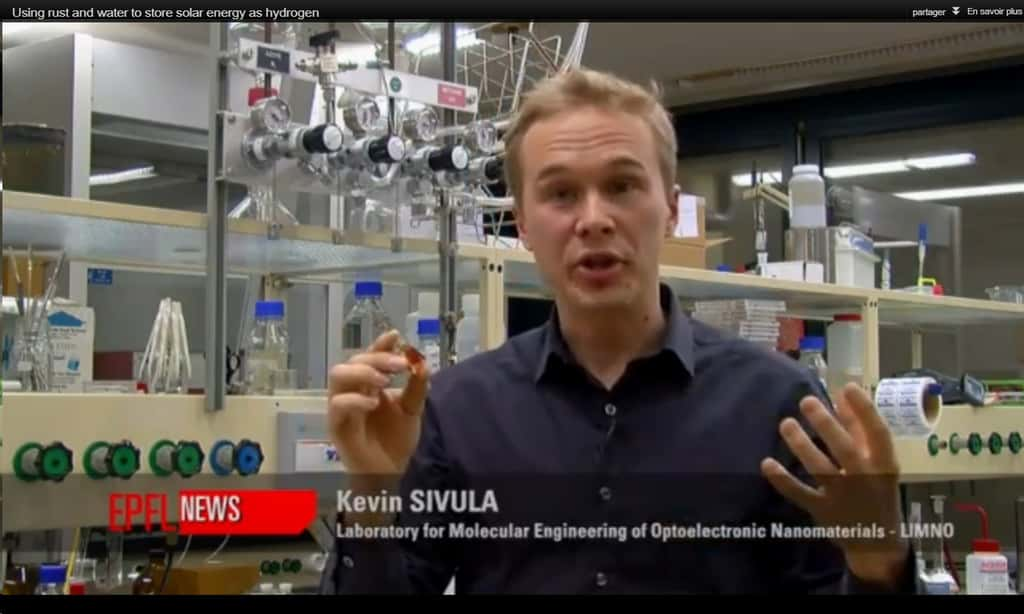
Des scientifiques suisses, dont Kevin Sivula, produisent de l'hydrogène à partir de l'énergie solaire, de l'eau et de la rouille. Un moyen écologique et peu onéreux de produire de l'énergie propre. © EPFL (capture d'écran de vidéo)
Dans la solution électrolytique, deux couches distinctes génèrent des électrons quand elles sont stimulées par la lumièrelumière. D'une part, un oxyde semi-conducteursemi-conducteur supervise l'évolution de la réaction de l'oxygèneoxygène et une cellule sensibilisée au colorant libère l'hydrogène d'autre part. D'après Kevin Sivula, un des auteurs de la publication, « le système est très intéressant d'un point de vue théorique mais cela coûterait 10.000 dollars de produire 10 cm² de surface ».
« L'oxyde de ferfer est l'un des pires semi-conducteurs ! »
Sivula et ses collègues ont ainsi volontairement limité leurs recherches à des matériaux peu onéreux et de grosse production. Dans leur cellule, le semi-conducteur qui gère la réaction de l'oxygène n'est que de l'oxyde de fer, autrement dit de la rouille. Pour l'instant, le rendement maximal de l'électrolyse est de 3,1 %, mais l'équipe suisse est confiante. « Avec notre concept moins onéreux basé sur l'oxyde de fer, nous espérons obtenir un rendement de 10 % dans quelques années, pour moins de 80 dollars par m². »
L'oxyde de fer est-il l'élément parfait ? Pas tout à fait. « C'est stable et abondant, il n'y a pas de risque que ça rouille davantage ! Mais c'est l'un des pires semi-conducteurs disponibles ! » admet Kevin Sivula. En conséquence, l'oxyde de fer utilisé dans la réaction redox n'est pas exactement la rouille que l'on trouve sur un clou. L'oxyde est renforcé avec de l'oxyde de siliciumsilicium, d'aluminiumaluminium et de cobaltcobalt. D'après l'équipe, ces traitements optimisent les propriétés électrochimiques du matériaumatériau et sont faciles à appliquer. La deuxième couche du dispositif est constituée d'un colorant et de dioxyde de titanedioxyde de titane, ce sont les ingrédients de base d'une cellule solaire à colorant.
Si l'oxyde de fer est révolutionnaire, le temps nous le dira. Ce qui est certain, c'est que ce procédé est basé sur deux oxydes (fer et titane) dont de nombreuses études feront rapidement progresser la technologie.