au sommaire

La progéria accélère le vieillissement de toutes les cellules à l'exception des neurones. Leon Botha (1985-2011), cet artiste de hip hop sud-africain atteint de la maladie, en est un exemple puisque le DJ était doté d'un esprit créatif. © euskopata, argazkiak.org, cc by sa 3.0
L'équipe de Xavier Nissan à l'Institut des cellules souches pour le traitement et l'étude des maladies monogéniques (I-Stem)) dirigé par Marc Peschanski, est parvenue à identifier un mécanisme moléculaire qui, dans la progéria, protège les cellules neurales d'un vieillissement accéléré. Ce travail, mené en collaboration avec l'équipe de Nicolas Lévy (université de la Méditerranée), a été réalisé grâce aux cellules souches pluripotentes induites (CSPi). Il permet de comprendre pourquoi les fonctions cognitives des patients atteints de cette maladie sont préservées. L'article a été publié en ligne le 21 juin 2012 dans la revue Cell Reports et a été financé notamment par l'AFMAFM-Téléthon.
Le syndrome de Hutchinson-Gilfordsyndrome de Hutchinson-Gilford, ou progéria, est une maladie génétique très rare (une centaine de cas dans le monde) qui induit un vieillissement prématuré et accéléré des patients. La mutation à l'origine de ce syndrome affecte le gène Lmna qui code pour les protéines appelées lamines A et C. Les lamines interviennent dans le maintien de la structure de la membrane des noyaux cellulaires. Elles donnent au noyau sa forme, la rendent rigide et permettent les communications à l'intérieur des cellules. Dans le cas de la progéria, c'est la lamine A qui est défaillante. Sous sa forme mutée, elle devient toxique et détériore les membranes du noyau, perturbe le message et cause le vieillissement accéléré des cellules. C'est en 2003 que l'origine de cette maladie a été mise en évidence par l'équipe de Nicolas Lévy, à partir de travaux déjà financés à l'époque par le Téléthon.
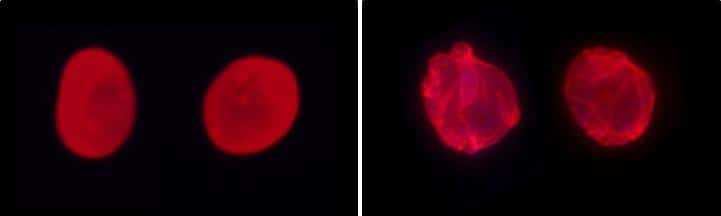
À gauche, des cellules saines ; à droite, des cellules atteintes par la progéria. Pour chacune d'entre elles, la lamine A a été marquée en rouge. La protéine n'est pas du tout organisée de la même façon. © Xavier Nissan, I-Stem
Des neurones protégés, mais pourquoi ?
L'évolution de ce syndrome est fulgurante : on estime que, chaque année, ces enfants vieillissent de plus de 10 ans, conduisant à leur décès prématuré entre 13 et 16 ans. Ce vieillissement accéléré touche la plupart des tissus : la peau, les vaisseaux sanguins, le cœur, les os ou encore les muscles. Très rapidement, les patients souffrent de troubles musculaires et squelettiques, d'un retard de croissance (la taille des malades ne dépassant pas 110 cm pour un poids de 15 kgkg). En revanche, ils ne perdent aucune de leurs capacités cognitives, ce qui a depuis toujours été considéré comme un phénomène surprenant, au vu de l'atteinte générale dont ils sont victimes par ailleurs.
Les équipes d'I-Stem multiplient les succès dans la maîtrise du potentiel thérapeutique des cellules souches (embryonnaires ou CSPi) comme dans l'identification des mécanismes moléculaires impliqués dans des pathologiespathologies rares. Cette fois, les chercheurs se sont penchés sur les mécanismes moléculaires impliqués dans la progéria. Partant du constat que dans ce syndrome, seules les cellules neurales étaient préservées du vieillissement accéléré, les chercheurs ont formulé l'hypothèse selon laquelle un mécanisme moléculaire physiologique présent de façon spécifique dans le système nerveux pouvait expliquer le phénomène. Ils ont identifié ce mécanisme sous la forme d'un contrôle épigénétique inhibiteur de l'expression du gène Lmna, assuré par un microARNmicroARN qui est naturellement exprimé massivement et uniquement dans les neurones.
Les cellules souches pour comprendre la progéria
Pour comprendre les mécanismes moléculaires de la progéria, les équipes d'Évry et de Marseille ont prélevé des échantillons de peau chez des malades et en ont dérivé des CSPi. Ces cellules ont ensuite été différenciées en plusieurs types cellulaires (cellules de peau, d'os, de muscle et du cerveau), ce qui a permis d'observer que toutes ces cellules exprimaient la protéine responsable de ce syndrome (la lamine A) à l'exception d'une, les cellules nerveuses, qui en étaient dépourvues. La préservation des cellules neurales chez les patients atteints de progéria tenait donc à l'absence d'expression du gène Lmna. L'origine de cette absence d'expression restait toutefois inconnue.
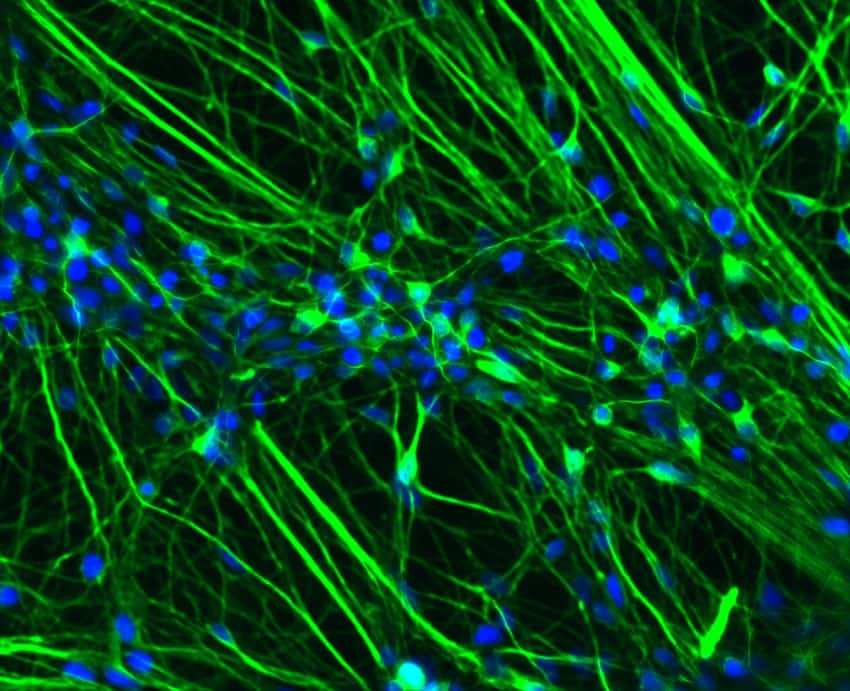
Ces neurones sont issus de malades atteints de la progéria. En bleu figure l'ADN, une protéine spécifique des neurones en vert, et la lamine A est marquée en rouge. Elle est ici absente. © Xavier Nissan, I-Stem
« Nous avions démontré que les neuronesneurones présentaient une particularité qui les protégeait du vieillissement accéléré observé dans la progéria. Il restait ensuite à comprendre les mécanismes qui conduisaient à cette absence d'expression de la lamine A au niveau neural, explique Xavier Nissan. Pour répondre à cette question, nous sommes partis à la recherche des facteurs qui pouvaient bloquer spécifiquement l'expression de ce gène au niveau du système nerveux centralsystème nerveux central et c'est là que nous avons identifié miRmiR-9. » Les chercheurs ont en effet mis en évidence le rôle de ce petit ARNARN, miR-9, membre d'une vaste famille de modulateurs épigénétiques.
L’ARN miR-9, solution thérapeutique ?
« Plusieurs informations nous ont laissé penser que miR-9 était un suspect idéal. D'abord parce que des travaux précédents avaient montré qu'il était un des microARN les plus abondants dans les neurones, et ensuite parce qu'il présente la particularité de n'être présent à cette concentration dans aucune autre cellule de l'organisme. » Ainsi, grâce à des manipulations diverses de son expression - en augmentant ou en abaissant sa concentration dans divers types cellulaires -, les chercheurs ont non seulement confirmé qu'il contrôlait bien la production de lamine A au niveau de neurones mais également qu'il pouvait corriger les désordres moléculaires associés à la maladie, en restaurant une morphologiemorphologie normale des noyaux.
L'objectif de Xavier Nissan et de son équipe est désormais de trouver un moyen pour utiliser ou imiter le microARN 9 à des fins thérapeutiques. Plusieurs travaux dans ce sens ont été lancés cette année dans les laboratoires d'I-Stem.