Pour la première fois, des chercheurs ont injecté dans le sang de patients malades une construction CRISPR-Cas9. Conséquence, la concentration de la protéine toxique à l'origine de la maladie a diminué !
au sommaire
Le ciseau moléculaire CRISPR-Cas9CRISPR-Cas9 a révolutionné l'édition génétique et ses perspectives d'applicationapplication semblent sans fin. Des médecins voient en lui le traitement de demain pour soigner les maladies génétiques. S'il a fait ses preuves lors d'études in vitroin vitro sur des cultures cellulaires, son application in vivoin vivo, que ce soit chez les humains ou les animaux, se confronte encore à beaucoup d'obstacles.
Mais les scientifiques des sociétés de biotechnologiesbiotechnologies Regeneron Pharmaceuticals et Intellia Therapeutics ont fait un énorme bond en avant. Dans une étude parue dans NEJM, ils présentent les résultats intermédiaires de la phase 1 de leur essai clinique mené sur un traitement, basé sur CRISPR-Cas9, contre l'amyloïdose à transthytérine. Leurs observations sont stupéfiantes.
Agir à la source
L'amyloïdose à transthyrétine est caractérisée par l'accumulation d'une forme anormale de la transthyrétine, la protéine qui transporte la vitamine A, dans l'organisme. Ce dysfonctionnement peut apparaître de façon sporadique, notamment chez les personnes âgées, ou être la conséquence d'une mutation génétique héréditaire. Le seul gène concerné est TTR, situé sur le chromosomechromosome 18. Les médecins ont identifié une centaine de mutations de ce celui-ci capables d'induire une forme pathologiquepathologique de la transthyrétine, qui s'accumule alors dans les nerfsnerfs, mais aussi le cœur et les reinsreins. L'amyloïdose à transthyrétine est une maladie mortelle, avec une espérance de vieespérance de vie médiane d'environ dix ans après le diagnosticdiagnostic. Des traitements existent pour ralentir son évolution, mais ils n'agissent pas à la source. Tandis que le traitement utilisant CRISPR-Cas9 si.
Couper le gène muté
Les scientifiques de Regeneron Pharmaceuticals et Intellia Therapeutics ont mis au point la constructionconstruction suivante : une nanoparticulenanoparticule de graisse protège une ARNARN guide, spécifique du gène TTR, ainsi qu'une autre moléculemolécule d'ARN, messager cette fois, qui code pour la protéine Cas9, le ciseau qui coupe l'ADNADN. Les nanoparticules ont été spécialement conçues pour cibler les hépatocytes, le foiefoie étant l'organe qui produit la majeure partie (95 %)) de la transthyrétine.
Ce traitement, appelé NTLA-2001, est injecté dans le sang et voyage ainsi jusqu'au foie. À son entrée dans les cellules, la bulle de graisse est dissoute, libérant son contenu. L'ARNmARNm de Cas9 est traduit en protéine et s'assemble à l'ARN guide pour former un complexe fonctionnel. Ce dernier pénètre dans le noyau et s'attaque au gène TTR. Il réalise une coupure double-brin dans l'ADN. La cellule fait en sorte de réparer cette blessure en recollant ensemble les deux extrémités, mais la séquence initiale est perdue. Le gène ne peut plus produire de transthyrétine.
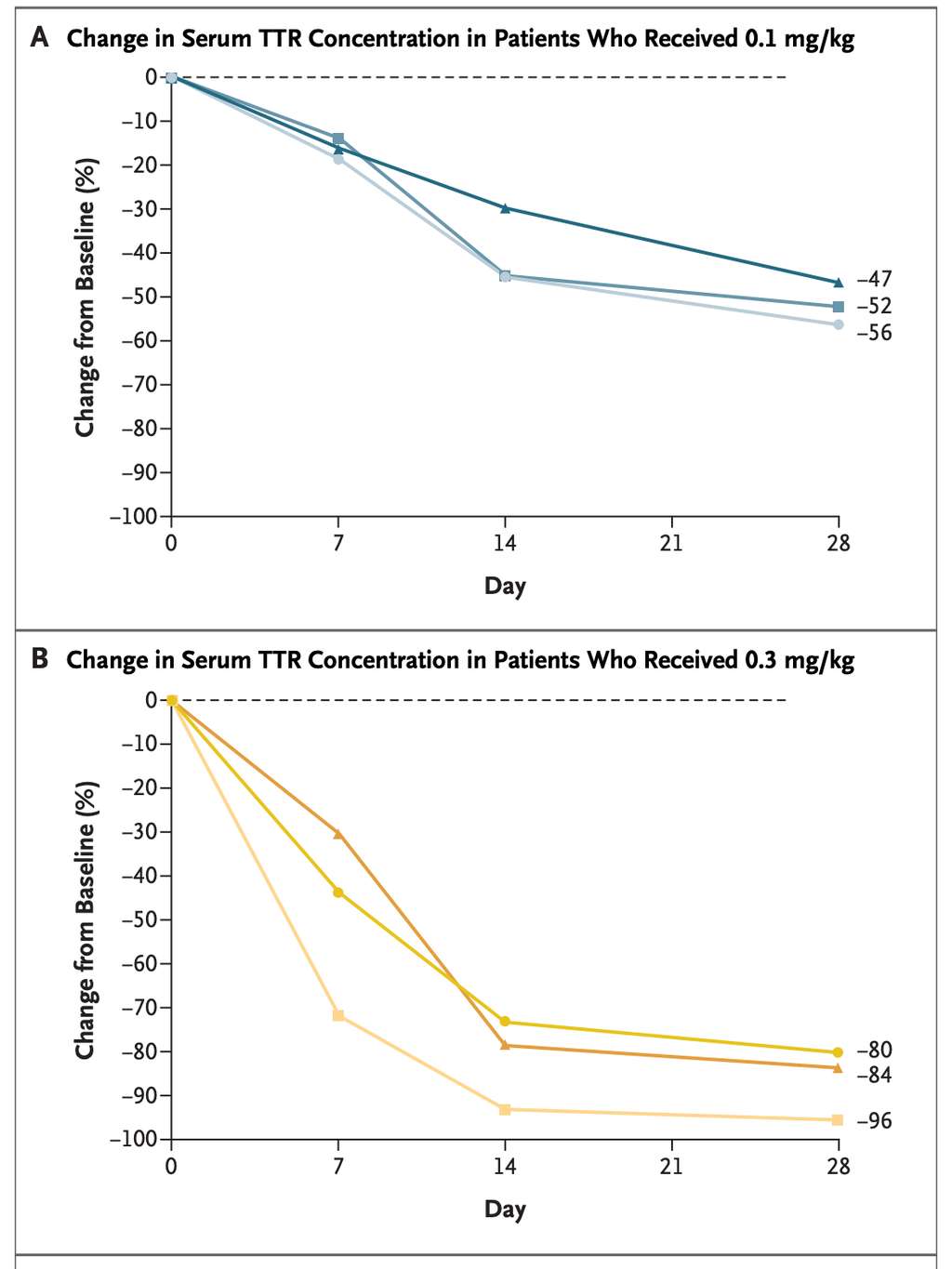
Cette approche a été testée sur six volontaires, atteints d'amyloïdose à transthyrétine, dans un hôpital d'Auckland, en Nouvelle-Zélande, et de Londres, en Angleterre. Les quatre hommes et les deux femmes ont reçu soit une dose de 0,1 mg/kilo ou de 0,3 mg/kilo de NTLA-2001 en intraveineuse. Les scientifiques ont suivi de près l'effet du traitement sur la quantité de transthyrétine dans le sérumsérum. Au bout de 28 jours, la concentration de la protéine a diminué de 52 % pour la dose la plus faible et de 87 % pour la plus forte. Le traitement n'a pas provoqué d'effets secondaires graves.
Encore des incertitudes
Modifier ainsi un gène peut avoir de lourdes conséquences. L'une des plus grandes craintes concernant le système CRISPR-Cas9 est que le ciseau coupe ailleurs qu'à l'endroit prévu, pouvant alors causer des mutations involontaires aux conséquences difficilement prévisibles. Ici, des expériences menées sur des hépatocytes humains n'ont pas engendré de mutations hors-cibles provoquées. Les seules variations dans l'ADN observées sont dues à la réparation dans la coupure initiale, qui selon les scientifiques, a peu de risque d'induire des problèmes.
Si la quantité de transthyrétine a bel et bien diminué, l'effet positif du traitement sur les symptômessymptômes de la maladie est encore à prouver. Le suivi des patients n'est pas encore assez long pour tirer une quelconque conclusion, il faudra encore attendre des mois. De plus, seulement six personnes ont bénéficié de ce traitement. C'est bien trop peu pour conclure que le traitement est sûr et efficace pour tout le monde. Malgré tout, ces résultats suggèrent que traiter les maladies génétiques avec CRISPR-Cas9 est de l'ordre du possible.
Jennifer Doudna, co-lauréate du prix Nobel de chimie de 2020 avec la Française Emmanuelle CharpentierEmmanuelle Charpentier pour la mise au point de la technologie CRISPR-Cas9, a réagi à ces travaux pour Science. Elle a déclaré : « C'est une première étape critique pour pouvoir inactiver, réparer ou remplacer tout gène qui cause une maladie, n'importe où dans le corps. »