Changer le plomb en or. Le rêve des alchimistes. Nous en sommes bien loin. Tout ce que la chimie peut vous proposer, c’est de transformer un fil de cuivre en arbre d’argent, le fameux arbre de Diane. Mais ce n’est déjà pas si mal. Les explications en vidéo de Laure-Lise Chapellet, docteur en chimie à l’ENS de Lyon.
au sommaire
Dans le parc de Diane, aux Clayes-sous-BoisBois (Yvelines), il se dresse un platane classé arbre remarquable de France. On l'appelle « arbrearbre de Diane ». Car il a été planté par la favorite d'Henri II de France, aux alentours de 1555. Il mesure aujourd'hui plus de 30 mètres de hauteur. Mais ce n'est pas à lui que l'expérience de l'« arbre de Diane » doit son nom.
Non, c'est plutôt à la déesse de la chasse. Une déesse qui, pour les alchimistes, était associée au métal argent. Et c'est ainsi que les végétations métalliques à base d'argent qui apparaissent lors de certaines réactions chimiques ont pris le nom d'« arbre de Diane ».
Pour reproduire l'expérience présentée dans la vidéo, côté matériel, il vous suffira d'un bécher de 250 mL.
Côté produits chimiques, il suffit des deux produits suivants, toujours à manipuler avec précaution :

Le protocole à suivre est le suivant :
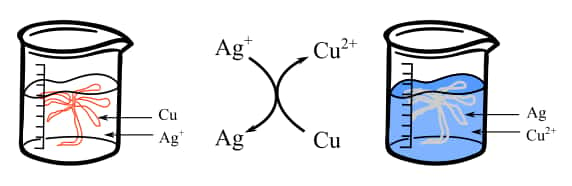
Remplir le bécher avec 200 mL de solution de nitrate d'argent (AgNO3)) et tremper le fil de cuivre torsadé dans la solution. Suivre l'évolution du système et l'apparition de l'argent. On obtient un bel « arbre de Diane » au bout de 25 minutes.
Comment apparaît l’arbre de Diane ?
Il s'agit d'une réaction d'oxydo-réduction entre les ions argent et le cuivre métallique :
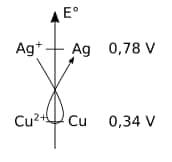
Le moteur thermodynamique de la réaction réside dans la différence de potentiel entre les couples d'oxydo-réduction qui peut être mis en évidence par la « règle du gamma » sur un axe en potentiel standard.
Les demi-équationséquations d'oxydo-réduction s'écrivent :
OxydationOxydation du cuivre :
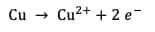
Réduction de l'argent :
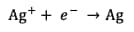
Réaction totale :
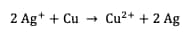
La constante d'équilibre de cette réaction s'exprime :
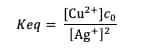
À l'équilibre, le potentiel de la solution peut s'écrire avec la relation de Nernst associée aux deux couples d'oxydo-réduction présents en solution :
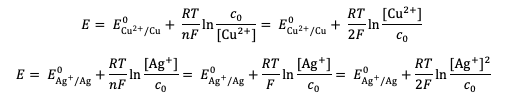
L'unicité de ce potentiel permet de soustraire ces deux équations et d'obtenir une nouvelle relation :
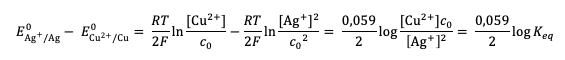
Ainsi, la constante d'équilibre de la réaction totale s'exprime :
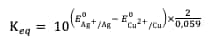
Par applicationapplication numériquenumérique, on obtient :
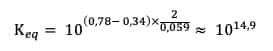
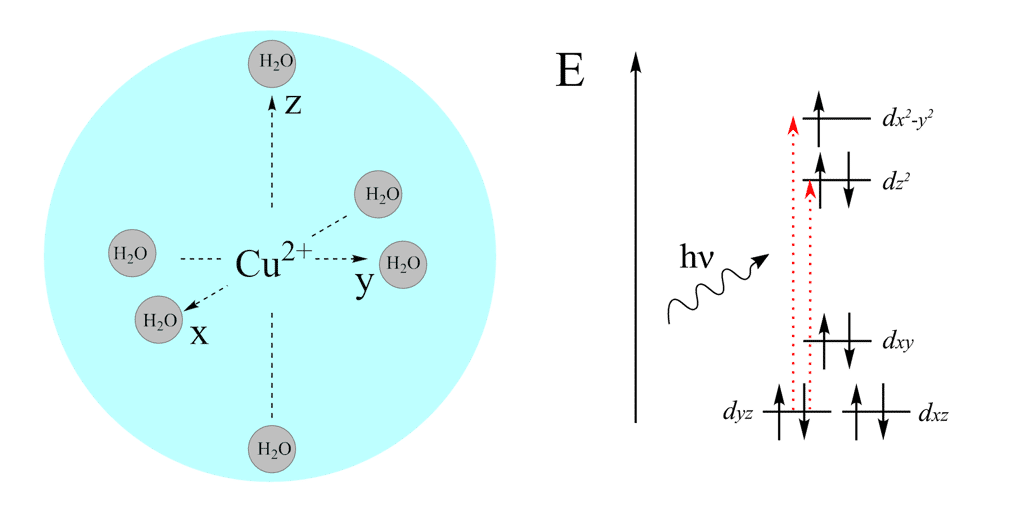
Origine de la couleur bleue
La couleur bleue du cuivre (II) en solution aqueusesolution aqueuse vient de la formation du complexe hexaaquacuivre (II) Cu(H2O)6 de géométrie octaédrique (en réalité un effet Jahn-Teller mène à un octaèdre déformé) pour lequel il y a absorptionabsorption des composantes rouges de la lumièrelumière ambiante (λmax = 850 nm). La lumière transmise à travers ce composé apparaît alors bleue.
Oxydation de l’argent métallique
L'argent métallique Ag s'oxyde avec l'oxygèneoxygène de l'airair en oxyde d'argent (Ag2O), de couleurcouleur noire, selon une réaction très lente qui peut être accélérée par la lumière :
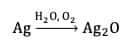
© Futura & ENS de Lyon









